
| A. | X:2s22p1 Y:2s22p4 | B. | X:3s23p1 Y:3s23p5 | ||
| C. | X:3s23p2 Y:2s22p3 | D. | X:3s2 Y:2s22p3 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、CO32- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Mg2+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1:4 | B. | 2:1:1 | C. | 1:1:1 | D. | 1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
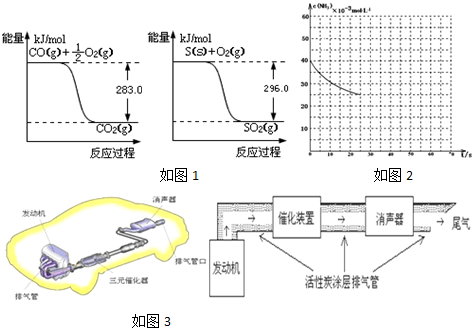
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
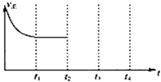 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com