
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
I.(1)配制500mL一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是___。
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为_,同时洗涤___(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
Ⅱ.探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式__;
②提出假设二的可能依据是___;
③验证假设三是否成立的实验操作是__。
(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为___;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是__(写化学式)。
(4)由上述实验可知,盐溶液间的反应存在多样性。经验证,(2)中实验假设一成立,则(3)中实验的产物不同于(2)实验的条件是__。
【答案】去除蒸馏水中的氧气,防止亚硫酸钠被氧化 500mL容量瓶 烧杯、玻璃棒 SO32-+2Ag+=Ag2SO3↓ Na2SO3被酸化的NO3-氧化成Na2SO4,Na2SO4与AgNO3溶液反应生成Ag2SO4沉淀 取固体少许加入足量Na2SO3溶液(或向试管中继续滴加Na2SO3溶液) Ag2O+4NH3·H2O=2Ag(NH3)2OH+3H2O或Ag2O+4NH3+H2O=2Ag(NH3)2OH AgOH Na2SO3溶液滴加顺序不同(或用量不同),溶液酸碱性不同(或浓度不同)
【解析】
配置一定物质的量浓度的溶液时,①溶解时:Na2SO3晶体易被溶液中溶解的氧气氧化,故需煮沸;②移液时:配置一定物质的量浓度的溶液时需要使用容量瓶,移液时需要洗涤烧杯和玻璃棒;
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
①假设一是银离子与亚硫酸根离子反应生成亚硫酸银;
②考虑加入的酸性的硝酸银溶液具有氧化性,将亚硫酸银氧化成硫酸银;
③由于Ag2SO3溶于过量Na2SO3溶液,可以加入Na2SO3溶液验证溶液中是否有Ag2SO3;
Ⅰ.(1)配制500mL一定浓度的Na2SO3溶液
①溶解时:Na2SO3晶体易被溶液中溶解的氧气氧化,故需煮沸,防止亚硫酸钠被氧化;
②移液时:配置一定物质的量浓度的溶液时需要使用500ml的容量瓶,移液时需要洗涤烧杯和玻璃棒2~3次;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
①假设一是银离子与亚硫酸根离子反应生成亚硫酸银SO32-+2Ag+= Ag2SO3↓;
②将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,酸性溶液中存在氢离子,氢离子和硝酸根相当于硝酸,具有氧化性,可能会将亚硫酸根离子氧化成硫酸根;
③.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液,故可以取固体少许加入足量Na2SO3溶液(或向试管中继续滴加Na2SO3溶液),看是否继续溶解,若继续溶解一部分,说明假设三成立;
(3)①Ag2O,棕黑色固体,不溶于水,可与浓氨水反应,反应a为Ag2O + 4NH3·H2O =2Ag(NH3)2OH + 3H2O;
②将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,由于亚硫酸银易溶于亚硫酸钠,故生成的白色沉淀不是亚硫酸银,溶液呈碱性,也不是硫酸银,银离子在碱性条件下,例如银离子和氨水反应可以生成氢氧化银,是白色沉淀,A为AgOH;
(4)实验(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,实验(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,对比两次实验可以看出,滴加顺序不同(或用量不同),所给盐溶液酸碱性不同(或浓度不同)。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成:

(1)写出反应①、④、⑦的化学方程式:①____________;④____________;⑦____________。
(2)②的反应类型是____________,上述七个反应中属于加成反应的有(填序号)____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中的NO经过O3预处理,再用CaSO3悬浊液吸收去除。预处理时发生反应:NO(g)+O3(g)![]() NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3,测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )
NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3,测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )

A.高温有利于提高容器中NO的平衡转化率
B.T1时,反应在t1min内的平均速率v(O2)=![]() mol·L-1·min-1
mol·L-1·min-1
C.T1时,NO(g)+O3(g)![]() NO2(g)+O2(g)的k正>3k逆
NO2(g)+O2(g)的k正>3k逆
D.T2时,向2L密闭容器中充入0.6molNO、0.4molO3,到达平衡时c(NO2)小于乙容器中平衡时c(NO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是( )

A.放电时,外电路电子由多孔碳材料电极流向镁电极
B.放电时,正极的电极反应式为O2+4e-+2H2O=4OH-
C.理论上,外电路中流过2mol电子时,负极质量增加34g
D.电池反应产物Mg(OH)2经过灼烧与还原可制成镁从而循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容条件下,反应:2SO2 (g) + O2 (g) ![]() 2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
容器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A. 在上述条件下反应生成lmol SO3固体放热Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+B2(g)![]() xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3>P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是( )

A.图I用于实验室制取氨气并收集干燥的氨气
B.图II用于除去CO2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV装置用于验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降冰片二烯类化合物是一类太阳能储能材料,降冰片二烯在紫外线照射下可以发生下列转化。下列说法错误的是
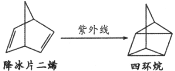
A.四环烷的一氯代物超过三种(不考虑立体异构)
B.降冰片二烯能使酸性高锰酸钾溶液褪色
C.降冰片二烯与四环烷互为同分异构体
D.降冰片二烯分子中位于同一平面的碳原子不超过4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铁铝合金与很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液x中,逐滴加入4molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。则下列有关计算和判断正确的是( )

A.溶液x中所含的阳离子有:Al3+、H+、Fe3+、Fe2+
B.在DE段,发生反应的离子方程式为NH4++OH﹣→NH3H2O
C.无法求出B点对应的沉淀的物质的量
D.C点对应的氢氧化钠溶液的体积为7mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com