
| V |
| Vm |
| m(NH3) |
| m(NH3)+m(H2O) |
| m |
| ρ |
| n |
| V |
| 350L |
| 22.4l/mol |
| 15.625mol×17g/mol |
| 1265.6g |


科目:高中化学 来源: 题型:
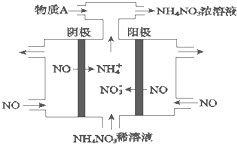 (1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为:
(1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
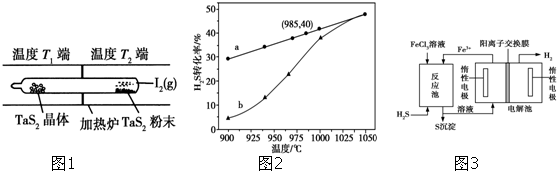
查看答案和解析>>
科目:高中化学 来源: 题型:


| 沸点/°C | 密度/g?cmˉ3 | 水中溶解性 | |
| 苯甲酸 | 249 | 1.2659 | 微溶于水 |
| 甲醇 | 64.6 | 0.7910 | 易溶于水 |
| 苯甲酸甲酯 | 198 | 1.0900 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
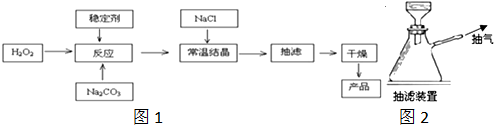
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管用蒸馏水洗净后,必须用已知浓度的盐酸润洗 |
| B、锥形瓶用蒸馏水洗净后,用NaOH溶液润洗后再加入待测液 |
| C、滴定时,必须逐出滴定管下口的气泡 |
| D、读数时,视线与滴定管内液体的凹液面最低处保持水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态氯化氢、固态氯化钠不导电,所以HCl、NaCl不是电解质 |
| B、NH3、CO2水溶液均能导电,所以NH3、CO2均是电解质 |
| C、蔗糖、酒精在水溶液中或熔化时不导电,所以它们不是电解质 |
| D、铜、石墨均导电,所以它们是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:NaHCO3>Na2CO3 |
| B、相同浓度溶液的碱性:Na2CO3<NaHCO3 |
| C、都能与酸反应放出CO2,但剧烈程度:NaHCO3>Na2CO3 |
| D、Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com