
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO(s)
MgO(s)
B.H2SO4(浓)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
C.Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)![]() Fe(s)
Fe(s)
D.SiO2(s)![]() H2SiO3(胶体)
H2SiO3(胶体)![]() Na2SiO3(aq)
Na2SiO3(aq)
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向0.10mol/L的HCOONH4溶液中通入HCl或加入NaOH固体调节溶液pH(忽略溶液体积变化),部分粒子的浓度随pH的变化关系如图所示。其中[NH3]表示溶液中NH3与NH3·H2O的浓度之和,M点的坐标为(6.5,-4)。下列说法不正确的是
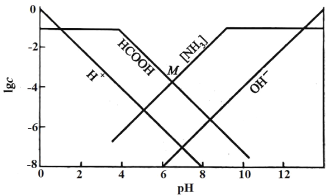
A.此温度下,Kw=1.0×10-14
B.pH<12时,溶液中[NH3]>c(OH-)
C.M点有c(HCOO-)>c(HCOOH)>c(NH4+)>c(H+)>c(OH-)
D.Ka(HCOOH)的数量级为10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中曲线表示短周期元素的原子序数(按递增顺序连续排列)及其常见最高化合价的关系,下列叙述不正确的是 ( )
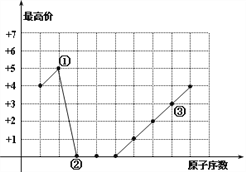
A. 单核简单离子半径大小为:②<③
B. ①、③可以按原子个数比1︰1形成化合物
C. ②、③形成的化合物是两性物质
D. ①、②形成的化合物的摩尔质量可能是44g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题。实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
硫酸 化学纯(CP)
(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
请回答下列问题:
(1)配制溶液时,一般可以分为以下几个主要步骤:
①量取 ②计算 ③溶解 ④定容 ⑤转移 ⑥洗涤 ⑦装瓶,其正确的操作顺序为________(填序号)。
(2)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制240 mL 0.1 mol·L-1的稀硫酸,需取该浓硫酸________ mL,计算所需浓硫酸的体积用到的公式___________。
(3)接下来完成此实验将用到的仪器有10 mL量筒、烧杯、玻璃棒、___________。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是_________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为________。
(5)下列操作会使所配溶液浓度偏高的是____(填字母)。
A 转移溶液时未洗涤烧杯
B 定容时俯视容量瓶的刻度线
C 容量瓶用蒸馏水洗净后仍残留有蒸馏水
D 用量筒量取浓硫酸,读数时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7g铝粉分别与体积为100mL、浓度均为2mol/L的①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积(相同条件)大小比较正确的是
A.①=②=③B.①=②>③C.①>②>③D.②>①=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素(Z)是一种治疗胆结石的药物。其合成涉及如下转化:
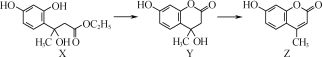
下列有关说法正确的是( )
A.X和Y分子中各含有1个手性碳原子
B.Y能发生加成反应、取代反应和消去反应
C.1 mol Y与足量NaOH溶液反应,最多消耗2 mol NaOH
D.1 mol Z与足量浓溴水反应,最多消耗2 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用![]() 和冰晶石(
和冰晶石(![]() )混合熔融电解制得。
)混合熔融电解制得。
①铝土矿的主要成分是![]() 和
和![]() 等。从铝土矿中提炼
等。从铝土矿中提炼![]() 的流程如下:
的流程如下:
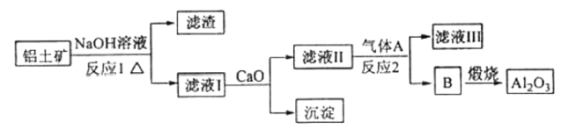
②以萤石(![]() )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下:

请回答下列问题:
(1)写出反应1的化学方程式____________。
(2)滤液1中加入![]() 生成的沉淀是____________,反应2的离子方程式为____________(气体
生成的沉淀是____________,反应2的离子方程式为____________(气体![]() 过量)。
过量)。
(3)![]() 可作为建筑材料,化合物
可作为建筑材料,化合物![]() 是浓硫酸,请写出由
是浓硫酸,请写出由![]() 制备冰晶石的化学方程式____________。
制备冰晶石的化学方程式____________。
(4)电解氧化铝制铝时,以石墨为电极,请写出阳极的电极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(![]() )在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。砷(
)在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。砷(![]() )是第四周期VA族元素,可以形成
)是第四周期VA族元素,可以形成![]() 、
、![]() 、
、![]() 等化合物,用途广泛。完成下列填空:
等化合物,用途广泛。完成下列填空:
(1)已知锗元素与碳位于同一主族,与钙位于同一周期。
写出锗在周期表中的位置:____________。
根据锗在元素周期表中的位置写出锗的一条用途____________。
(2)将![]() 溶于浓盐酸,可以得到
溶于浓盐酸,可以得到![]() ,其沸点为
,其沸点为![]() 。
。
推测![]() 的晶体类型为______。
的晶体类型为______。
已知![]() 沸点高于
沸点高于![]() ,请从结构角度解释原因:____________。
,请从结构角度解释原因:____________。
将![]() 与
与![]() 作用可以得到
作用可以得到![]() ,
,![]() 水溶液呈______性(填“酸”“碱”或“中”)。
水溶液呈______性(填“酸”“碱”或“中”)。
(3)锗金属对人类具有保健功能,适宜人体接触佩戴。锗金属非常脆,容易破碎,一种常用的方法是将锗制成颗粒镶嵌到其他金属上,但存在易脱落的缺点。请提出一种改进建议:____________。
(4)砷原子核外有______个电子层,最外层有______个电子;比较溴、砷最高价氧化物对应水化物酸性的强弱:____________强于____________(填物质的化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com