
【题目】下列说法不正确的是
A. 油脂可以制造肥皂和油漆
B. 工业酒精中含有乙醇,不含甲醇
C. 工业上可以用淀粉、纤维素为原料生产葡萄糖
D. 天然气与煤、柴油相比是清洁的能源
科目:高中化学 来源: 题型:
【题目】下列陈述正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
⑴其中操作正确的同学是___ _____。
⑵证明有Fe(OH)3胶体生成利用的胶体性质是______ __。
⑶在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行实验:
① 将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带__________(填“正”或“负”)电荷。
② 若向其中加入饱和Na2SO4溶液,产生的现象是 。
③若向其中加入浓盐酸溶液,产生的现象是 。
(4)Fe(OH)3胶体制备的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是( )
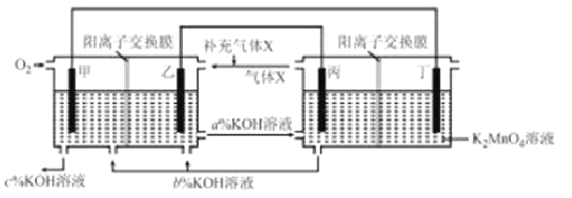
A. 电极丁的反应式为MnO42--e-= MnO4-
B. 电极乙附近溶液的pH减小
C. KOH溶液的质量分数:c%>a%>b%
D. 导线中流过2 mol电子时,理论上有2mol K+ 移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
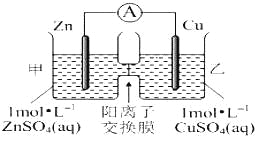
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是()
A. 原子半径:Cl>S>P B. 还原性:Na>Mg>Al
C. 稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取7.90gKMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+存在。
请计算:
(1)KMnO4的分解率_______________。
(2)气体A的物质的量_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有________________________________。
(2)加入BaCl2的目的是_______________,加MgO后过滤所得滤渣的主要成分为___。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________________________,
再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
①蒸发结晶;②___________;洗涤;③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定(已知Mg(ClO3)2·6H2O的摩尔质量为299g/mol )。
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。反应的方程式为:
______Cr2O72-+___Fe2++___ H+= ___Cr3++___Fe3++____H2O (请配平)。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
写出步骤2中发生反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向质量分数为2a%,体积为10 mL,物质的量浓度为c1mol·L-1的稀H2SO4中加入V mL 的水,使之质量分数变为 a%,此时物质的量浓度为c2mol·L-1,则下列关系正确的是
A. V>10, 2c2=c1 B. V<10,2c2﹤c1
C. V>10,2c2<c1 D. V>10, 2c2>c1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com