
断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
| 化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
| E/kJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=______________(用含有a、b的关系式表示)。
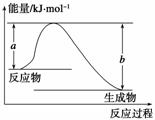
(2)若图示中表示反应H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________kJ·mol-1,x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________kJ·mol-1,x=__________。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧 气跟氯化氢反应制氯气。反应的化学方程式为___________________________。
气跟氯化氢反应制氯气。反应的化学方程式为___________________________。
若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电 子转移时,反应的能量变化为______________。
答案 (1)放热 (a-b) kJ·mol-1 (2)926 496.4 (3)O2+4HCl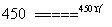 2Cl2+2H2O 放出 能量31.4 kJ
2Cl2+2H2O 放出 能量31.4 kJ
解析 (1)反应物的能量高于生成物,因此是放热反应。反应热为反应物与生成物的能量之差,即ΔH=(a-b)kJ·mol-1。
(2)b表示H、O原子结合为气态水时的能量变化,其数值为463×2=926;436+ x-926=-241.8,则x=496.4。
x-926=-241.8,则x=496.4。
(3)根据题意易写出方程式。反应的ΔH=(496.4+431×4-247×2-463×4) kJ·mol-1=
-125.6 kJ·mol-1,则转移1 mol电子时反应放出的能量为31.4 kJ。


科目:高中化学 来源: 题型:
现有A~H 8种短周期元素,它们在元素周期表中的位置如下.请据此回答下列问题:
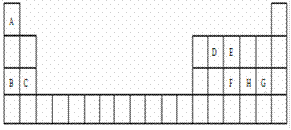
(1)下列中的元素的原子间反应最容易形成离子键的是________
A.C和F B.B和G C.D和G D.B和E
(2)下列由A~G形成的各分子中所有原子都满足最外层为8电子结构的是_ _ ___。
A.EA3 B.AG C.FG5 D.DG4
(3)由A、E组成的一种化合物化学式为EA5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式________。
(4)均由A、B、H和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体.这两种化合物中有一种相对分子质量为120,该化合物溶于水时破坏的是___ ___(填化学键类型).
查看答案和解析>>
科目:高中化学 来源: 题型:
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需要吸收的能量分别为160 kJ、330 kJ,则S(s)+3F2(g)===SF6(g)的反应热ΔH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________ ;碘电极作为该电池的________极。
;碘电极作为该电池的________极。
(2)[2012·北京理综,26(1)]已知反应A:4HCl+O2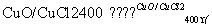 2Cl2+2H2O
2Cl2+2H2O
ⅰ.反应A中, 4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

①H2O的电子式是____________。
②反应A的热化学方程式是_______________________________________________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
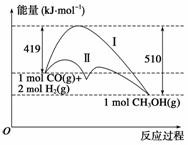
A.该反应的ΔH=91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
完成下列填空:
1写出上述制备小苏打的化学方程式。________________________
2滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是__________(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
3提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是____________________________。
滤渣的主要成分是_________________、_________________。
4.称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。
实验中所需的定量仪器除滴定管外,还有__________________。
选甲基橙而不选酚酞作为指示剂的原因是_________________。
样品中NaHCO3的质量分数为__________________。(保留3位小数)
5.将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com