
| A. | 生成白色沉淀 | |
| B. | 生成红褐色沉淀 | |
| C. | 有气泡产生 | |
| D. | 先生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
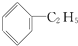 与
与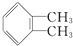
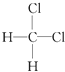 与
与
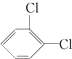 与
与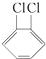
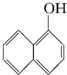 与
与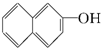
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
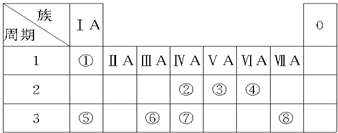
 或
或 .
.查看答案和解析>>
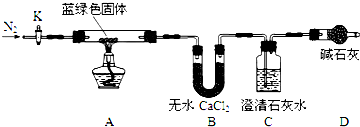
科目:高中化学 来源: 题型:解答题
| 溶解度(S)/p | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+02(g)=2H20(1)△H=-285kJ•mol-1 | |
| B. | 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多 | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应转移电子的数小于0.6×6.02×1023 | |
| D. | 已知中和热为57.3kJ•mol-1,若将含0.5molH2S04的浓硫酸溶液与含1mol Na0H的溶液混合,放出的热量要小于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | Z在周期表中的位置是第三周期第IA族 | |
| C. | X的气态氢化物的还原性比W的弱 | |
| D. | W比Y更容易与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中有1个氢原子与其他氢原子不一样 | |
| B. | 乙醇分子可认为是由乙烷分子中的一个-H被一个-OH取代产生的 | |
| C. | 乙醇分子中的每个碳原子都形成了四个共价键,但显示化合价不是+4价 | |
| D. | 乙醇的相对分子质量为46,相对分子质量为46的有机物就是乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com