
【题目】有一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是( )

A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
C. 电极b是正极, O2-由电极a流向电极b
D. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
【答案】B
【解析】
本题中固体电解质是Y2O3-Na2O,O2-可以在其中自由移动;通甲烷气体的为负极,通空气一端为正极,电池总反应为CH4+2O2=CO2+H2O,正极反应为:O2+4e-=2O2-,负极反应为:CH4+5O2--8e-=CO32-+2H2O,结合原电池的工作原理可得结论。
A.该电池中a为负极,b为正极,电子从负极流向正极,所以电池内电路中O2-由电极b流向电极a,故A错误;
B.甲烷所在电极a为负极,电极反应为:CH4+5O2--8e-=CO32-+2H2O,故B正确;
C.电极b氧气得电子,生成O2-,而电极a需要O2-作为反应物,故O2-由正极(电极b)流向负极(电极a),故C错误;
D.1mol O2得4mol电子生成2molO2-,故当固体电解质中有1mol O2-通过时,电子转移2mol,故D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下, SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。

2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。

①tl 时刻达到平衡后,改变一个条件使化学反应速率发生如下图所示的变化,则改变的条件是________。
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,n(SO3)的取值范围是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是 ( )

A. t1时刻前,A1片的电极反应为:2A1+3H2O - 6e- ═ A12O3+6H+
B. t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应
C. t1之后,负极Cu失电子,电流方向发生改变
D. 烧杯中发生的离子反应为:2NO2+2OH- ═ 2NO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时AgCl的Ksp=2×10-10;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
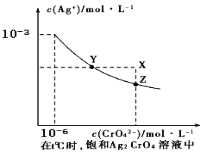
A. 在t℃时,Ag2CrO4的Ksp为1×10-9
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D. 在t℃时,AgCl的溶解度大于Ag2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用.请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为__mol/L.( 保留小数点后 1 位)
(2)该同学参阅此“84 消毒液”的配方,欲用NaClO固体配制480mL 与市售物质的量浓度相同的“84 消毒液”,下列说法中正确的是__( 填序号).
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84 消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用 98%( 密度为1.84g/cm3)的浓硫酸配制 500mL 2.3mol/L 的稀硫酸用于增强“84 消毒液”的消毒能力.
①需用浓硫酸的体积为__mL.
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3mol/L有__。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com