
下列关于pH=12的Na2CO3溶液说法正确的是
| A.升高溶液温度,溶液pH增大 |
| B.c(Na+) +c(H+)=c(CO32-)+ c(HCO3-)+ c(OH-) |
| C.溶液中c(OH-)>c(HCO3-)> c(H+) |
| D.2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |
AC
解析试题分析:碳酸钠是强碱弱酸盐,少部分碳酸根离子能够水解,即CO32—+H2O HCO3—+OH—,该水解反应是吸热反应,升高温度,促进碳酸根离子水解,氢氧根离子浓度增大,溶液的pH增大,故A选项正确;B项,违反电荷守恒原理,碳酸钠溶液中存在Na+、H+、CO32-、HCO3-、OH-,由于溶液呈电中性,则阳离子的正电荷总浓度等于阴离子的负电荷总浓度,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B选项错误;碳酸根离子的水解分两步进行,CO32—+H2O
HCO3—+OH—,该水解反应是吸热反应,升高温度,促进碳酸根离子水解,氢氧根离子浓度增大,溶液的pH增大,故A选项正确;B项,违反电荷守恒原理,碳酸钠溶液中存在Na+、H+、CO32-、HCO3-、OH-,由于溶液呈电中性,则阳离子的正电荷总浓度等于阴离子的负电荷总浓度,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B选项错误;碳酸根离子的水解分两步进行,CO32—+H2O HCO3—+OH—,HCO3—+H2O
HCO3—+OH—,HCO3—+H2O H2CO3+OH—,第一步水解程度大于第二步水解,碳酸钠溶液呈碱性,则溶液中c(OH-)>c(HCO3-)> c(H+),故C选项正确;D项,违反物料守恒原理,因为碳酸钠中钠离子是碳酸根离子的2倍,则平衡时溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D选项错误。
H2CO3+OH—,第一步水解程度大于第二步水解,碳酸钠溶液呈碱性,则溶液中c(OH-)>c(HCO3-)> c(H+),故C选项正确;D项,违反物料守恒原理,因为碳酸钠中钠离子是碳酸根离子的2倍,则平衡时溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D选项错误。
考点:考查水溶液中粒子浓度大小关系,涉及酸与盐溶液中电荷守恒关系式、溶液pH、水的离子积、电离平衡移动、溶液的酸碱性、盐与盐溶液中物料守恒关系式等。


科目:高中化学 来源: 题型:单选题
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 ? H2O的电离常数Kb=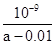 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有物质的量浓度均为0.1mol·L-1的①NaOH溶液 ② Na2CO3溶液 ③CH3COONa溶液各25mL,下列说法正确的是
| A.3种溶液pH的大小顺序是①>②>③ |
| B.若将3种溶液稀释相同倍数,pH变化最大的是③ |
| C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是② |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.0.1 mol·L-1醋酸溶液中:c(H+)= c(CH3COO-)+c(OH-) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.同温度同浓度的NaOH和澄清石灰水中,水的电离程度相同 |
| D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关电解质溶液中微粒的关系不正确的是
| A.25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.25℃时,pH=3的氯化铵溶液中: c(OH-)=1.0×10-11mol·L-1 |
| C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 |
| D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列叙述错误的是
A.向0.1mol·L-1的醋酸溶液中加水或通入HCl气体都能使 值增大 值增大 |
| B.0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) |
| C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
D.0.1mol·L-1某一元酸HA溶液中 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列有关叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: |
B.Na2CO3溶液中, |
C.pH相等的CH3COONa、NaClO、NaHCO3三种溶液: |
D.NH4Cl溶液和NaOH溶液混合所得的中性溶液中: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成溶液。下列有关推断正确的是( )
A.若该溶液中HA电离能力大于A-水解能力,则有c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(HA)>(Na+)>c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com