
如图,烧杯中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。(2)若试管内液面上升 ,则原溶液呈 ,发生 腐蚀,电极反应:负极 ;正极 。
,则原溶液呈 ,发生 腐蚀,电极反应:负极 ;正极 。
(3)若试管内液面下降,则原溶液呈 性,电极反应:负极 ;正极 。
科目:高中化学 来源: 题型:
由A、B两种气态烃组成的混合气体,对H2的相对密度为17。常温常压下,取这种混合气体10mL与80mL氧气(过量)混合,当完全燃烧后恢复到原状态时,测得气体的体积为70mL。试求:
①混合气体的平均组成为(用CxHy的形式表示)___________;
②若上述两种气体按体积1:1混合时,则两种气态烃的可能组成为__________________。
(2)(5分)具有支链的化合物X的分子式为C4H8O,X既能使Br2的四氯化碳溶液褪色,又能与Na反应。①X的结构简式是 ,
②写出与X具有相同官能团的X的所有同分异构体的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、300 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成
NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 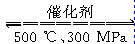 2NH3(g)
2NH3(g)
ΔH=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应:Mg2++2OH-===Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O===2[Al(OH)4]-
查看答案和解析>>
科目:高中化学 来源: 题型:
电解装置如图所示。图中B装置盛1 L 2 mol·L-1的Na2SO4溶液,A装置中盛1 L 2
mol·L-1 AgNO3溶液。通电后,湿润的淀粉KI试纸的C端变蓝色。电解一段时间后,试回
答:
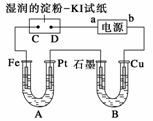
(1)A中发生反应的化学方程式为_________________________________________。
(2)在B中观察到的现象是_____________________________________________。
(3)室温下若从电解开始到时间t时,A、B装置中共收集到0.168 L(标准状况)气体。若电
解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A溶液中酸的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
聚四氟乙烯的耐热性和化学性质的稳定性都超过了其他材料,号称“塑料王”。在工业生产上有广泛的应用,其合成路线如图所示:
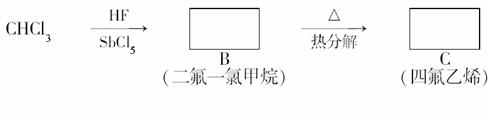
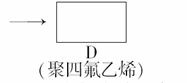
(1)在方框内填写合适的有机物的结构简式。(2)写出下列反应的化学方程式 :
:
B―→C________________________________________________________________________;
C―→D________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)通过点燃的方法可以鉴别聚乙烯和聚氯乙烯。如果塑料点燃时有强烈的刺激性气味,这种塑料可能是由 制成的。
(2)某同学设计了如图所示实验来验证塑料燃烧的产物。
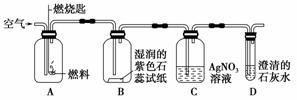
若A瓶燃烧的是聚氯乙烯塑料,在B瓶中可以看到的现象是________________________________________________________________________,
C、D两瓶中发生反应的化学方 程式为____
程式为____ ____________________________________________________________________。
____________________________________________________________________。
若A瓶中 用的是聚乙烯塑料,则在C瓶中 (“能”或“不能”)观察到沉淀。
用的是聚乙烯塑料,则在C瓶中 (“能”或“不能”)观察到沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)

② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是: 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4)= v逆(H2)如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH = 。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是: 、 、能连续工作。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com