
| A. | 室温下,用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液的pH | |
| B. | 将 4 mL 0.0lmol•L-1 KSCN溶液与1 mL 0.01 mol•L-1 FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡Fe3++3SCN-?Fe(SCN)3 | |
| C. | 测定中和反应的反应热时,将碱的稀溶液缓慢倒入一定量的稀醋酸溶液中,所测反应后混合液温度值偏小 | |
| D. | 测定NaaSO4溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
分析 A.NaClO溶液水解生成HClO具有强氧化性,漂白pH试纸;
B.增加KSCN溶液,颜色加深,说明生成更多的Fe(SCN)3;
C.稀醋酸电离要吸热;
D.测定等浓度的Na2CO3和Na2SO4溶液的pH,可知硫酸的酸性大于碳酸的酸性.
解答 解:A.NaClO溶液水解生成HClO具有强氧化性,漂白pH试纸,看不出pH试纸颜色,则不能用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液的pH,故A错误;
B.增加KSCN溶液,颜色加深,说明生成更多的Fe(SCN)3,则能证明溶液中存在平衡Fe3++3SCN-?Fe(SCN)3,故B正确;
C.稀醋酸电离要吸热,所以测定中和反应的反应热时,将碱的稀溶液缓慢倒入一定量的稀醋酸溶液中,所测反应后混合液温度值偏小,故C正确;
D.测定等浓度的Na2CO3和Na2SO4溶液的pH,可知硫酸的酸性大于碳酸的酸性,则说明非金属性:S>C,故D正确.
故选A.
点评 本题考查化学实验方案的评价,侧重于基本实验的操作的考查,涉及pH的测定、非金属性的比较、中和热的测定和平衡移动的问题,题目难度不大,注意把握相关基础知识.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH2Cl | B. | CH2=CH-COOH | C. | CH3-CH(OH)-COOH | D. | H2N-CH2-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序为:Z>Y>X>W | |
| B. | 元素的非金属性:X>Y | |
| C. | 若X的单质为常见的非金属导体,则含Y的离子在水溶液中呈酸性 | |
| D. | 若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由石油制取乙烯、丙烯等化工原料不涉及化学变化 | |
| B. | 向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应 | |
| C. | 鲜花运输途中需喷洒高锰酸钾稀溶液,主要是为鲜花补充钾肥 | |
| D. | 牙膏中添加的Na3PO3F、NaF提供的氟离子浓度相等时,它们防治龋齿的作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔬菜和粗粮中富含纤维素,纤维素在人体中酶的作用下能水解成葡萄糖 | |
| B. | 混凝法、中和法、沉淀法、氧化还原法是工业处理废水常用的方法 | |
| C. | 可只用淀粉溶液检验食盐中是否加碘 | |
| D. | 鸡蛋清溶液中加人饱和Na2SO4溶液,有沉淀生成是因为蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH5+、-OH、NH3各1mol,所含的电子数均为10NA | |
| B. | 20℃、101kPa条件下,11.2L丁烷中含极性共价键的数目大于5NA | |
| C. | 78gNa2O2和Na2S的固体混合物中含有的阴离子数目一定是NA | |
| D. | 0.1mol•L-1AlCl3溶液中含有Al3+的数目一定小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
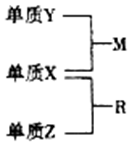 X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂.下列说法不正确的是( )
X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂.下列说法不正确的是( )| A. | X元素位于周期表中的第16列 | |
| B. | X的氢化物沸点一定高于Y的氢化物的沸点 | |
| C. | X、Y、Z元素可以组成一种分子式为Z2Y2X4的化合物,其水溶液中水的电离受到了抑制 | |
| D. | X、Y、Z元素两两之间均能形成原子个数比为1:1的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | |||
| E | X | Y |
| A. | X的氢化物稳定性比R的氢化物稳定 | |
| B. | E和Y组成的化合物溶于水能促进水的电离 | |
| C. | 0.1mol/L的Y的最高价氧化物对应水化物的pH=1 | |
| D. | E与足量一水合氨反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com