
�����£�������Һ�� 0.1 mol?L-1 NH3��H2O �� 0.1 mol?L-1 NH4Cl�У�
��1����Һ����pH 7��������������������������������ԭ���ǣ� ���õ��뷽��ʽ��ʾ����
��2����Һ���� �ԣ�����������������������������ˮ�ⷴӦ�����ȷ�Ӧ�����¿��� �������ٽ���������������NH4Cl��ˮ�⡣
��3�����й���������Һ��c��NH4+�� ��������ȷ���� ������ĸ����
a��������Һ��c��NH4+�� ������0.1 mol?L-1
b��������Һ��c��NH4+�� ��С��0.1 mol?L-1
c��NH4Cl��Һ��c��NH4+�� С��NH3��H2O��Һ��c��NH4+��
��1������1�֣� NH3��H2O  NH4+ +OH�� ��2�֣�
NH4+ +OH�� ��2�֣�
��2���ᣨ1�֣� �ٽ���1�֣�
��3��b ��1�֣�
��������
�����������1��NH3��H2O���������ˮ�в��ֵ������NH4+ ��OH��������pH>7,
��2��NH4Cl��Һ�е�NH4+ˮ���ʹ��Һ�����ԣ�pH<7,ˮ�ⷴӦ�����ȷ�Ӧ������ʹƽ�������ȷ�Ӧ������У���˻�ٽ�NH4Cl��ˮ�⡣
��3��a��NH3��H2O���������ȫ���룻NH4Cl��Һ��NH4+����ˮ�⣬����������ҺNH4+ ��Ũ�Ⱦ�С��0.1mol/l������b����ȷ��c��������Һ��NH4+��Ũ�ȵĴ�С�ɵ���̶Ⱥ�ˮ��̶ȵ�ǿ�����жϣ����������ж�,��ѡb��
���㣺������Һ������ԡ�������ʵĵ��롢�ε�ˮ�⡢���������ƽ���Ӱ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�߶���ѧ�ڵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�鴦�������е��� �� ��
������ ��NaOH�Ĵ���Һ�����Ʊ�CH3��CH�TCH2
��NaOH�Ĵ���Һ�����Ʊ�CH3��CH�TCH2
���������ͼ�ȩ�Ļ�����м�������������Һ���кͼ���������Ƶ�������ͭ�������������������Ƿ��м�ȩ
��������ϩȩ��CH2=CH��CHO��������KMnO4(H+)��Һ���۲���ɫ��ȥ����֤���ṹ�д���̼̼˫��
����Ϊ��֤ijRX�ǵ���飬��RX���ռ�ˮ��Һ��ϼ��Ⱥ���Һ��ȴ���ٵ��뼸����������Һ���۲�����
A��ֻ���٢� B��ֻ���٢ڢ�
C��ֻ���ڢۢ� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и߶���ѧ����ĩ��⻯ѧ�Ծ���A���������棩 ���ͣ������
̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ�����á�
��1�����̼�Ȼ�ԭ���Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
��2Al2O3(s)��2AlCl3(g)��6C(s) = 6AlCl(g)��6CO(g) ��H��a kJ��mol��1
��3AlCl(g) �� 2Al(l)��AlCl3(g) ��H��b kJ��mol��1
��Ӧ��Al2O3(s)��3C(s)��2Al(l)��3CO(g)����H �� kJ��mol��1 (�ú�a��b�Ĵ���ʽ��ʾ)��
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC(s)+2NO(g)  N2(g)+CO2(g) ��H =Q kJ��mol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H =Q kJ��mol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��/min Ũ��/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1��00 | 0��68 | 0��50 | 0��50 | 0��60 | 0��60 |
N2 | 0 | 0��16 | 0��25 | 0��25 | 0��30 | 0��30 |
CO2 | 0 | 0��16 | 0��25 | 0��25 | 0��30 | 0��30 |
��0��10 min�ڣ�NO��ƽ����Ӧ����v(NO)�� ��T1��ʱ���÷�Ӧ��ƽ�ⳣ���� ��
��30 min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������ (����ĸ���)��
A��ͨ��һ������NO B������һ�����Ļ���̿
C��������ʵĴ��� D���ʵ���С���������
���ں��������£����жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬�������� (��ѡ����)��
A����λʱ��������2 n mol NO(g)��ͬʱ����n mol CO2(g)
B����Ӧ��ϵ���¶Ȳ��ٷ����ı�
C�����������ܶȲ��ٷ����ı�
D ��Ӧ��ϵ��ѹǿ���ٷ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и߶���ѧ����ĩ��⻯ѧ�Ծ���A���������棩 ���ͣ�ѡ����
���ݵ���������Ӧ���Ȼ�ѧ����ʽ
��1��I2(g)+ H2(g)  2HI(g) ��H����9��48 kJ/mol
2HI(g) ��H����9��48 kJ/mol
��2��I2(s)+ H2(g)  2HI(g) ��H����26��48 kJ/mol
2HI(g) ��H����26��48 kJ/mol
�����ж���ȷ����
A��254 g I2(g)��ͨ��2 gH2(g)����Ӧ����9��48 kJ
B��1 mol��̬����1 mol��̬���������������17��00 kJ
C����Ӧ��2���ķ�Ӧ���������ȷ�Ӧ��1���ķ�Ӧ����������
D����Ӧ��1���IJ���ȷ�Ӧ��2���IJ����ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и߶���ѧ����ĩ��⻯ѧ�Ծ���A���������棩 ���ͣ�ѡ����
��Ӱ��ˮ�ĵ���ƽ�⣬��ʹ��Һ�е�c(H��)��c(OH��)�Ĵ�ʩ��
A����ˮ��ͨ��SO2 B����ˮ�������
C����ˮ��Ͷ��һС������� D����ˮ�м���NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ӱ�ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������µ��������ͼ����Һ����Ϻ�pHһ��С��7���� ��
A��pH=3�������pH=11������������Һ
B��pH=3�������pH=11�İ�ˮ
C��pH=3�������pH=11������������Һ
D��pH=3�Ĵ����pH=11������������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ӱ�ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з���ʽ������ˮ�ⷴӦ����
A��HCO3��+H2O  H3O++CO32��
H3O++CO32��
B��HCO3��+H2O  OH��+H2CO3
OH��+H2CO3
C��NH3+H2O  NH4++OH��
NH4++OH��
D��HCO3��+OH�� =CO32��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ӱ�ʡ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
A��B�����л��������Ժ��ֱ�����ϣ�ֻҪ���������������䣬��ȫȼ��ʱ����CO2����Ҳ���䣬�����A��B�Ĺ�ϵ������������ȷ����
��A��Bһ����Ϊͬ���칹�� ��A��Bһ����Ϊͬϵ�� ��A��Bһ��������ͬ�����ʽ
��A��B��̼����������ͬ��������ȷ����
A���٢ڢۢ� B���ۢ� C���ڢ� D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ��������У�߶���ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ������
10000Cʱ�������ƿ�������������Ӧ: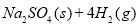

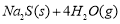 ����ش��������⣺
����ش��������⣺
��1��������Ӧ��ƽ�ⳣ������ʽΪ�� ��
��2��������Ӧ��������ͬ�����½��У�����H2��Ũ����ʱ��ı仯��ͼ��ʾ��
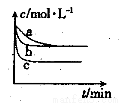
��������a�Ƚϣ�b��c�ֱ���ı�һ�ַ�Ӧ������������b�ı������Ϊ
���÷�Ӧ����H___0����������������������=���������ж������� ��
��3�����¶��£���2Lʢ��1.42g Na2SO4���ܱ�������ͨ��H2,5min����
��������Ϊ1.10g�����ʱ�䷶Χ�ڵ�ƽ����Ӧ����v(H2)= ��
��4����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ������ĸ����ͬ����
a.������ѹǿ���ֲ���
b.�����������ܶȱ��ֲ���
c.c(H2)=c(H2O)d.v��(H2)=v��(H2O)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com