
| A. | 共价键的饱和性是由成键原子的未成对电子数决定的 | |
| B. | 共价键的方向性是由成键原子的轨道的方向性决定的 | |
| C. | 共价键的饱和性决定了分子内部的原子的数量关系 | |
| D. | 共价键的饱和性与原子轨道的重叠程度有关 |
分析 一般的,原子的未成对电子一旦配对成键,就不再与其他原子的未成对电子配对成键了;
形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,这种成键的方向性也就决定了所形成分子的构型.
解答 解:A、C.一般的,原子的未成对电子一旦配对成键,就不再与其他原子的未成对电子配对成键了,故原子的未成对电子数目决定了该原子形成的共价键具有饱和性,这一饱和性也就决定了该原子成键时最多连接的原子数,故A、C正确;
B.形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,则共价键的方向性是由成键原子的轨道的方向性决定的,故B正确;
D.共价键的饱和性与原子轨道的重叠程度无关,与原子的未成对电子数有关,故D错误;
故选D.
点评 本题主要考查了共价键饱和性和方向性的决定因素,难度不大,注意对应知识的掌握.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依次使用Na2CO3溶液和盐酸,可除去锅炉水垢中的CaSO4 | |
| B. | 草木灰溶液能够去除油污 | |
| C. | 低血糖症状出现时,吃馒头要比喝葡萄糖水见效快 | |
| D. | 若发生液氨泄漏,人应尽量往上风向处较低的位置转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一个多电子原子中,不可能有两个运动状态完全相同的电子 | |
| B. | 在一个多电子原子中,不可能有两个能量相同的电子 | |
| C. | 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 | |
| D. | 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
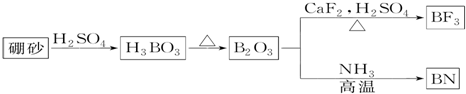
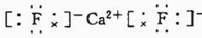 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g乙炔、苯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol甲基与1mol羟基所含电子数均为10 NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com