
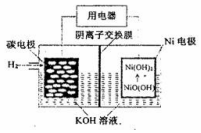
| A. | 放电时,OH-向碳电极迁移 | |
| B. | 放电时,负极反应NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,镍电极与电极的正极相连 | |
| D. | 充电时,碳电极区溶液pH增大 |
分析 放电时,该装置是原电池,负极上失电子发生氧化反应,电极反应式为H2-2e-+2OH-═2H2O,正极上得电子发生还原反应,电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-;充电时,该装置是电解池,负极碳电极与电源的负极相连,正极Ni电极与电源的正极相连,据此解答.
解答 解:A.放电时,负极上失电子发生氧化反应,电极反应式为H2-2e-+2OH-═2H2O,则碳电极为原电池的负极,OH-向负极碳电极迁移,故A正确;
B.放电时,正极上得电子发生还原反应,电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,故B错误;
C.充电时,负极碳电极与电源的负极相连,正极Ni电极与电源的正极相连,故C正确;
D.充电时,碳电极上的反应为2H2O+2e-═H2↑+2OH-,则碱性增强,pH增大,故D正确;
故选B.
点评 本题考查了原电池和电解池原理,明确各个电极上得失电子及反应类型是解本题关键,难点是电极反应式的书写,要结合电解质溶液书写,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 | |
| B. | 500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 已知热化学方程式:2SO2(g)+O2?(g) 2SO3(g)△H=-Q kJ/mol,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| D. | X(g)+Y(g)?Z(g)△H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、K+、I-、Cl- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | K+、Cu2+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
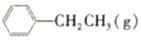 ?
?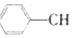 =CH2(g)+H2(g)
=CH2(g)+H2(g)| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0% | |
| B. | 反应在前20分钟的平均速率为v(H2)=0.008molmol/( L•min) | |
| C. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ | ⑧ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥均需要用石灰石做原料 | |
| B. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、煤的干馏、海水晒盐、从菜籽中提取菜籽油等过程都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
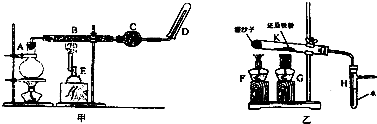
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com