


科目:高中化学 来源: 题型:
| A、利用丁达尔现象可以区别溶液和胶体 |
| B、胶体都可以发生丁达尔现象 |
| C、胶体粒子的大小都在1nm-100nm之间 |
| D、加热氢氧化铁胶体没有明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化钠溶液 |
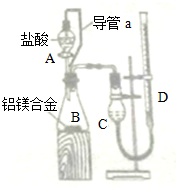
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、Fe3+、NO3-、OH- |
| B、HCO3-、Cl-、Na+、H+ |
| C、Ba2+、Cl-、NO3-、K+ |
| D、NH4+、K+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
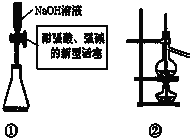
| A、装置①量取15.00 mLNaOH溶液 |
| B、装置②既可用于乙醇制乙烯的发生装置,又可用于分离沸点相差较大的互溶液体混合物 |
| C、室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色 |
| D、纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
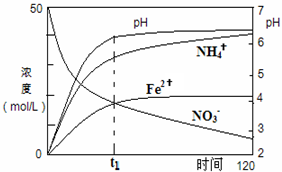 氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com