
【题目】目前世界锂离子电池总产量超过30亿只,锂电池消耗量巨大,黄石一重点中学化学研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如图:

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写岀氢氧化钠的电子式___。
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是___。
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求___。
(4)写出反应④生成沉淀X的离子方程式___。
(5)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:___。
(6)生成Li2CO3的化学反应方程式为___。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应___。
【答案】![]() 增大接触面积,加快反应速率 隔绝空气和水分 CO2+AlO
增大接触面积,加快反应速率 隔绝空气和水分 CO2+AlO![]() +2H2O=Al(OH)3↓+HCO
+2H2O=Al(OH)3↓+HCO![]() 4LiMn2O4+4H++O2=8MnO2+4Li++2H2O Li2SO4+Na2CO3=Na2SO4+Li2CO3↓ 趁热过滤
4LiMn2O4+4H++O2=8MnO2+4Li++2H2O Li2SO4+Na2CO3=Na2SO4+Li2CO3↓ 趁热过滤
【解析】
废料中含有的成份为LiMn2O4、石墨粉和铝箔,加入NaOH溶液后,Al与其反应生成NaAlO2,过滤Ⅰ得到滤液Ⅰ为NaAlO2溶液,滤液Ⅰ中通入CO2后得到Al(OH)3沉淀,滤渣为LiMn2O4和石墨粉,滤渣中通入空气和硫酸反应转化为MnO2和Li2SO4,过滤Ⅱ得到滤液Ⅱ是Li2SO4溶液,与Na2CO3反应得到Li2CO3沉淀,故过滤Ⅲ可得到Li2CO3沉淀。
(1)根据电子式书写的原则,可以很快写岀氢氧化钠的电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,粉碎可以增大与NaOH溶液的接触面积,可以加快反应速率,故其目的是增大接触面积,加快反应速率,故答案为:增大接触面积,加快反应速率;
(3)废旧电池可能由于放电不完全而残留有锂单质,由于锂单质和金属钠一样会与空气中氧气反应且能与水蒸汽反应产生H2,对环境造成污染,带来安全隐患,为了安全对拆解环境的要求为隔绝空气和水分,故答案为:隔绝空气和水分;
(4)由分析可知反应④为NaAlO2溶液中通入过量的CO2,故其离子方程式为CO2+AlO![]() +2H2O=Al(OH)3↓+HCO
+2H2O=Al(OH)3↓+HCO![]() ,故答案为:CO2+AlO
,故答案为:CO2+AlO![]() +2H2O=Al(OH)3↓+HCO
+2H2O=Al(OH)3↓+HCO![]() ;
;
(5)己知LiMn2O4中Mn的化合价为+3和+4价,与稀硫酸和空气反应生成了MnO2,故反应②的离子反应方程式为4LiMn2O4+4H++O2=8MnO2+4Li++2H2O,故答案为:4LiMn2O4+4H++O2=8MnO2+4Li++2H2O
(6)生成Li2CO3是硫酸锂和碳酸钠反应,故化学反应方程式为Li2SO4+Na2CO3=Na2SO4+Li2CO3↓,已知Li2CO3在水中的溶解度随着温度升高而减小,为了减小Li2CO3因溶解造成损失,故最后一步过滤时应趁热过滤,故答案为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓ 趁热过滤。


科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察到的现象是__________________,通入过量二氧化碳的离子方程式是_________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
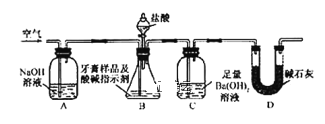
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____。
(4)C中反应生成沉淀的离子方程式是________。
(5)下列各项措施中,不能提高测定准确度的是___(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.0g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化硅)制取纯GeO2的主要流程如下:

已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的熔点为-49.5℃,沸点是84℃。
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式__________________________。
(2)用水浸取焙烧物长达2小时的目的是____________________________。
(3)调节pH可选用的试剂溶液a是________(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)“滤渣”的主要成分是________(填化学式)。
(5)“酸化”至溶液中盐酸浓度为5.3mol·L-1时有利于生成四氯化锗,写出该反应的化学方程式___________________________。
(6)操作“X”的名称为__________。
(7)四氯化锗与高纯水反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨反应N2(g)+ 3H2(g) ![]() 2NH3(g) △H<0,当反应器中按n(N2): n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a,b,c如下图所示。下列说法正确的是( )
2NH3(g) △H<0,当反应器中按n(N2): n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a,b,c如下图所示。下列说法正确的是( )

A. 曲线a对应的反应温度最高
B. 上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q)<K(N)
C. 相同压强下,投料相同,达到平衡所需时间关系为c>b>a
D. N点时 c(NN3)=0.2 mol/L,则 N点的c(N2): c(NH3)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液加热反应可制取氯气,他们设计如下实验用于制取氯气并验证其性质。
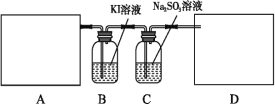
试回答:
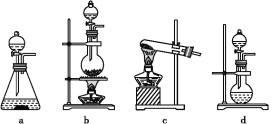
(1)该实验中A部分的装置是___________ (填写字母)。A部分的装置中发生反应的化学方程式为:___________。
(2)B中的发生反应的离子方程式为____________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因:___________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)__________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及所得出的结论或解释均正确的是( )
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向次氯酸钙溶液中通入二氧化硫 | 产生白色沉淀 | 酸性:H2SO3>HClO |
B | 向废FeCl3蚀刻液X中加入少量的铁粉,振荡 | 未出现红色固体 | X中一定不含Cu2+ |
C | 向饱和硅酸钠溶液中加入浓盐酸 | 产生白色沉淀 | 制取硅酸胶体 |
D | 铬酸钠溶液中加入浓硫酸 | 溶液由黄色变为橙色 | 氢离子浓度对该反应的化学平衡有影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)-236kJ,完成下列填空:
Si(s)+4HCl(g)-236kJ,完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为 2L,经 3min 后达到平衡,获得固体的质量 8.4 g,则用 H2 表示的平均反应速率为_________。
(2)该反应的平衡常数表达式 K=_________,若欲使 K 增大,可采取的措施是_________。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是_________。
a.2v 逆(SiCl4)=v 正(H2) b.断开 4mol Si-Cl 键的同时,生成 4mol H-Cl 键
c.混合气体密度保持不变 d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第 1.5 分钟v(正) ____ v(逆)(填><或=),第 3 分钟改变的条件是_______,各平衡态中氢气转化率最小的时间段是_______。
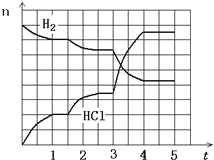
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用CO2和NH3合成尿素[CO(NH2)2],该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法错误的是( )
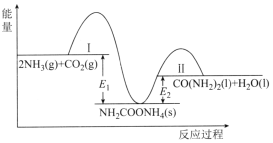
A.NH2COONH4为合成尿素反应的中间产物
B.反应Ⅰ逆反应的活化能>反应Ⅱ正反应的活化能
C.反应Ⅱ在热力学上进行趋势很大
D.2NH3(g)+CO2(g)![]() CO(NH2)2(1)+H2O(1)的焓变△H=El-E2
CO(NH2)2(1)+H2O(1)的焓变△H=El-E2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com