
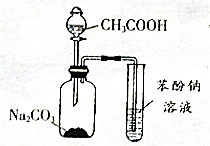
 下列关于如图实验的说法错误的是( )
下列关于如图实验的说法错误的是( )| A. | 集气瓶中的离子方程式是:2CH3COOH+CO32-→2CH3COO-+H2O+CO2 ↑ | |
| B. | 少量的CO2通入苯酚钠中生成苯酚和碳酸钠 | |
| C. | 醋酸和苯酚钠发生反应 | |
| D. | 该装置和相关实验现象能推出酸性强弱顺序为:CH3COOH>H2CO3 >C6H5OH |
分析 A、醋酸的酸性强于碳酸;
B、根据酸性:H2CO3>苯酚>HCO3-来分析;
C、根据酸性:CH3COOH>H2CO3>苯酚来分析;
D、根据强酸制弱酸的原理来分析.
解答 解:A、由于醋酸的酸性强于碳酸,故醋酸能和碳酸钠反应制出二氧化碳,离子方程式为:2CH3COOH+CO32-→2CH3COO-+H2O+CO2 ↑故A正确;
B、由于酸性:H2CO3>苯酚>HCO3-,故无论通入的二氧化碳的量是少量还是过量,CO2均与苯酚钠反应生成NaHCO3,故B错误;
C、根据酸性:CH3COOH>H2CO3>苯酚可知,醋酸的酸性强于苯酚,故醋酸能和苯酚钠反应制出苯酚,故C正确;
D、根据强酸制弱酸的原理可知,根据CH3COOH能和碳酸钠反应制出二氧化碳可知,CH3COOH的酸性强于H2CO3 ;根据二氧化碳能和C6H5ONa反应制出C6H5OH可知,H2CO3 的酸性强于C6H5OH,故酸性强弱顺序为:CH3COOH>H2CO3 >C6H5OH,故D正确.
故选B.
点评 本题考查了复分解反应发生的条件以及酸性强弱的比较,应注意的是强酸制弱酸.难度不大.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应物是体积比1:3的乙醇和3mol/L硫酸的混和液 | |
| B. | 温度计插入反应溶液液面以下,以便控制反应温度 | |
| C. | 反应容器烧瓶中应加入少许瓷片 | |
| D. | 反应完毕先灭熄灭酒精灯,再从水槽中取出导管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| B. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| C. | H2、SO2、CO2三种气体都可用浓H2SO4干燥 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中共价键键能越高,键长越长,则分子越稳定 | |
| B. | 元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键 | |
| C. | 水分子可表示为H-O-H,分子中键角为180° | |
| D. | N-N、N=N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡不移动 | |
| B. | 再达平衡时,n(A):n(B):n(C)仍为2:2:1 | |
| C. | 再达平衡时,C的体积分数增大 | |
| D. | 若将容器改为恒压容器,则平衡向右移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com