
| A. | 6.72L | B. | 4.48L | C. | 2.24L | D. | 1.12L |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA | |
| B. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为$\frac{a}{56}$NA | |
| D. | 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
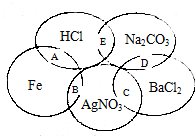 如图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
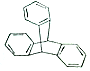 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )| A. | 分子式为C20H14 | B. | 属于苯的同系物 | ||
| C. | 能与溴水发生加成反应 | D. | 分子中所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Cu2+、NO3-、S2- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | Fe3+、K+、Cl-、I- | D. | Fe2+、Fe3+、Cu2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)2、Fe(OH)3;Fe3O4 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)2、Fe(OH)3;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com