
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+)/c(NH3•H2O)先增大再减小 | |
| C. | 当加入氨水的体积为10 mL时,溶液中的离子浓度:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10 mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
分析 A.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大,当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小;
B.根据一水合氨的电离平衡常数可知,该比值与氢氧根离子成反比,电解氨水的过程中,溶液中氢氧根离子浓度逐渐增大;
C.CH3COOH和NH3•H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性,根据电荷守恒判断;
D.溶液中的pH=7,说明反应生成醋酸铵,醋酸铵溶液中醋酸根离子和铵根离子都发生水解,促进了水的电离.
解答 解:A.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故A错误;
B.当向CH3COOH溶液中滴加相同浓度的氨水,NH4+的水解常数为:Kh=$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$,随着氨水的加入,溶液中c(H+)逐渐减小、Kh不变,c(NH4+)/c(NH3•H2O)逐渐减小,所以该比值始终减小,故B错误;
C.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),故C正确;
D.当加入氨水的体积为10mL时,溶液的pH=7,反应后溶质为醋酸铵:c(H+)=c(OH-),但醋酸铵是弱酸弱碱盐双水解,对水的电离起促进作用,所以由水电离出的c(H+)>1×10-7,故D错误;
故选C.
点评 本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确根据电荷守恒、物料守恒、盐的水解比较溶液中离子浓度大小的方法,试题培养了学生的分析、理解能力及综合应用用能力.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3 | B. | NaOH | C. | MgSO4 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)+c(H+)═c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(HS-)>c(OH-)>c(H+) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(K+)>c(HS-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X 的化学式为AgS | |
| B. | 每生成1molX会转移2 mol电子 | |
| C. | 反应中Ag、H2S均是还原剂 | |
| D. | 银针验毒时,空气中的氧气发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
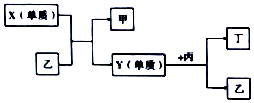 现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且甲、乙、丙均为10电子的分子.Y、Z结合生成化合物丁.有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图,下列说法正确的是( )
现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且甲、乙、丙均为10电子的分子.Y、Z结合生成化合物丁.有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图,下列说法正确的是( )| A. | 原子半径的大小:W<Y<Z<X | B. | 单质与H2化合的难易程度:X>Y | ||
| C. | 甲与丙反应不可能生成离子化合物 | D. | Z的最高价氧化物的水化物为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 简单氢化物的稳定性:X>Y>Z | |
| C. | W分别与X、Z形成的化合物均能抑制水的电离 | |
| D. | 在化合物A 的分解反应中丙为氧化产物,丁为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 通KSCN溶液变红色的溶液:NH4+、Al3+、SO42-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com