
分析 (1)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
(2)依据盖斯定律,结合题干热化学方程式计算写出;
(3)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2.
解答 解:(1)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
故答案为:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
(3)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故答案为:N2H4+4OH--4e-=N2+4H2O.
点评 本题考查盖斯定律、氧化还原反应、原电池原理,为高频考点,明确化学基本原理是解本题关键,难点是电极反应式的书写,燃料电池中负极上都是燃料发生氧化反应,注意结合电解质溶液酸碱性书写,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |
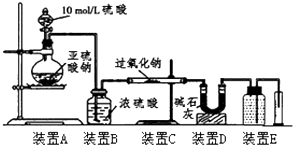
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | 0<V<$\frac{7{m}_{1}}{30}$或m1>$\frac{30V}{7}$ |
| 未被氧化 | V=$\frac{7{m}_{1}}{30}$或m1=$\frac{30V}{7}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的摩尔质量为36.5 g/mol,O2的摩尔质量为16g/mol | |
| B. | 常温下,2.7克铝与足量的盐酸反应,失去的电子数为0.3 NA | |
| C. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| D. | 标准状况下,11.2 L CCl4中含氯原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸均具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为2 mol/L | |
| C. | 配制480 mL 0.5 mol/L的CuSO4溶液,需称取62.5 g胆矾 | |
| D. | 中和100 mL 1mol/L的H2SO4溶液,需NaOH为4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2气体使高锰酸钾溶液褪色,体现了SO2的漂白性 | |
| B. | 在AgNO3的溶液中加入锌粉,能置换出银,说明AgNO3的还原性比Zn(NO3)2强 | |
| C. | 浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 | |
| D. | 浓硫酸放入蔗糖中,能使蔗糖碳化,说明浓硫酸具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.836 | 5.672 | 8.508 |
| 生成气体的体积(标准状况)/L | 1.12 | 2.24 | 2.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大N的投入量 | C. | 添加催化剂 | D. | 加大X的投入量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com