
����Ŀ����ͼװ�ã�A��B�еĵ缫Ϊ��Ķ��Ե缫��C��DΪ����ʪ��Na2SO4��ֽ�����ĵIJ��У���Դ��a��b����������A��B�г���KOH��Һ������KOH��Һ��ˮ���У��ж�K1 �� �պ�K2��K3ֱͨ���磬�ٱ����Դ������������aΪ����bΪ����
����ʪ��Na2SO4��Һ��ֽ�����ĵ�KMnO4Һ�Σ���ʲô���� ��
��д���缫��Ӧʽ��
A�� ��
B�� ��
�������һ��ʱ���A��B�о��������Χ�缫����ʱ�ж�K2��K3 �� �պ�K1 �� ���������ָ���Ƿ��ƶ������ǻ�� �� ��������ָ�벻�ƶ�˵�����ɣ���ָ���ƶ�Ҳ˵������ �� 
���𰸡�����������ɫ��D�����ƶ������������������4OH����4e=2H2O+O2����4H++4e=2H2�����ǣ��������ȼ�ϵ��
���������⣺���ж�K1 �� �ϱ�K2��K3ֱͨ���磬�缫A��B������������Һ���ɵ��أ��������ӵķŵ�˳����Һ�������ӡ����������ӷŵ磬�ֱ����������������������������������Ϊ2��1��ͨ��ͼ��֪��B�������������A�������������2��������B���ϵ�������A���ϵõ�����������B����������A������������a�Ǹ�����b��������
���Դ��ǣ����������ڽ��������Ƶ���ֽ�͵缫C��D���ԴҲ�����˵��أ���Ϊa�Ǹ�����b������������C��������D���������������Һ�е������Ӽ������������ƶ��������Ӹ�����������������ƶ�������D������ɫ���������Һ�������Ӻ����������ӷŵ磬�����������϶��õ����壮
���Դ��ǣ���ɫ��D�����ƶ��������������������A��������������ʧ��������������ˮ���缫��ӦʽΪ4OH����4e=2H2O+O2����B���������ӵõ��������������缫��ӦʽΪ4H++4e=2H2����
���Դ��ǣ�4OH����4e=2H2O+O2����4H++4e=2H2�������ж�K2��K3 �� �ϱ�K1 �� ���һ��ʱ���A��B�о��������Χ�缫����װ�ù�������ȼ��ԭ��أ������е���ͨ������������ָ���ƶ���
���Դ��ǣ��ǣ��������ȼ�ϵ�أ�


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D����ѧ�����Ļ���������ᴿ�Ļ���װ�ã�
����ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ������װ�ã���A��B��C��D �����ʵ��Ŀո��У�
��1������ֲ���ͺ�ˮ��
��2����ȥ�����е���ɳ��
��3���뺣ˮɹ��ԭ�����Ƶ�����
��4�������Ȼ�̼��ˮ����ȡ����
��5������CCl4���е㣺76.75�棩�ͼױ����е㣺110.6�棩�Ļ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ���ͭ��ӡˢ��·�����120mL�Ȼ���Ũ��Һ�У���9.6gͭ����ʴ����ȡ��ӡˢ��·�壬����Һ�м���8.4g���ۣ�����ַ�Ӧ����Һ�л�����4.8g���ܽ�����ʣ�������Һ������䣬�Ҳ����ǽ�������ˮ�⣩����ش��������⣺
��1����ַ�Ӧ����Һ�д���4.8g������ijɷ�Ϊ���û�ѧʽ��ʾ����
��2����ַ�Ӧ����Һ��һ�������ڵĽ�������Ϊ ��
��3���Ƚ�Fe2+��Fe3+��Cu2+�������Դ�С�� ��
��4���Լ��������Һ��Fe2+���ӵ����ʵ���Ũ��mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ�����Թ�������ﯩ�������Ϊ����ʣ����ֹ��������ڸ��������������ӣ�O2���������ͨ�����õ�صĹ���ԭ����ͼ��ʾ�����ж�缫a��b��������缫��Ӧ�������ж���ȷ���ǣ� �� 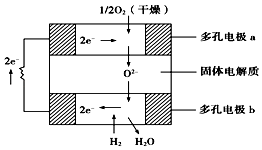
A.��O2�μӷ�Ӧ��a��Ϊ��صĸ���
B.b���ĵ缫��ӦʽΪH2+O2����2e���TH2O
C.a����Ӧ�ĵ缫��ӦʽΪO2+2H2O+4e���T4OH��
D.����ﯵ��������õ����ڵ���ڲ�ͨ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧ�������Ӧǰ��Ԫ�ػ��ϼ۷����ı䣬��һ����ת�ƣ����෴Ӧ��������Ӧ�����Ԫ�ػ��ϼ����ߣ�������Ԫ��ԭ�����ӣ�����Ԫ�ص����ʷ�����Ӧ����������������Ԫ�ػ��ϼ۽��ͣ�������Ԫ�ص�ԭ�����ӣ�����Ԫ�ص����ʷ�����Ӧ��������������������ѧ��ѧ�г���������������������дһ�֣���������ԭ��������������дһ�֣�������������ȼ�յĻ�ѧ����ʽ�����У���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������1000mL1mol/LNaCl��Һ����������²��裺�ټ��㣺��Ҫ������NaCl����
�ڳ�����������������壮
���ܽ⣺�������õ�NaCl���嵹���ձ��м�ˮ�ܽ⣬���ָ������£�
��ת�ƣ����ձ��е���Һ�ò���������ת�����У�
��ϴ�ӣ�������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ת��������ƿ �����û�н�ϴ��Һת��������ƿ��������Һ��Ũ�Ƚ�����ƫ���ƫС��
����ҡ��������ҡ����ƿ��ʹ��Һ��Ͼ���
�߶��ݣ�������ƿ�м�ˮ������̶���1��2���״���������
��ˮ����Һ��Һ����̶������У�
��ҡ�ȣ����µߵ�ҡ�ȣ�ʹ��Һ��Ͼ���
��װƿ��ǩ�������ƺõ���Һת�Ƶ��Լ�ƿ�У����ϱ�ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȲΪԭ����ȡCHClBr��CH2Br�����з���������е���( )
A.����HBr�ӳɺ�����HCl�ӳ�
B.����H2��ȫ�ӳɺ�����Cl2��Br2ȡ��
C.����HCl�ӳɺ�����Br2�ӳ�
D.����Cl2�ӳɺ�����HBr�ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I2��KI��Һ�д�������ƽ�⣺I2(aq)+I-(aq)һI3-(aq),ijI2��KI�����Һ�У�I3-�����ʵ���Ũ��c(I3-)���¶�T�Ĺ�ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ���ǣ� ��
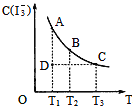
A. ��ӦI2(aq)+I-(aq)=I3-(aq)��H<0
B. ���¶�ΪT1��T2��Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2,��K1>K2
C. ����Ӧ���е�״̬Dʱ��һ����v��>v��
D. ״̬A��״̬B��ȣ�״̬A��c(I2)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���µ�HCl����4.48L����ˮ�γ�100ml��Һ��Ȼ������������м��ַ�Ӧ�����㣺
��1��������������ʵ���Ũ�ȣ�
��2������H2�������
��3�������ɵ�FeCl2���400ml��Һ������Һ��FeCl2�����ʵ���Ũ���Ƕ��٣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com