
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
4FeS2+11O2![]() 2Fe2O3+8SO2 4FeS+7O2
2Fe2O3+8SO2 4FeS+7O2![]() 2Fe2O3+4SO2
2Fe2O3+4SO2
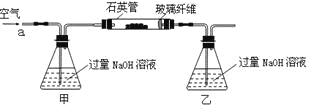
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:
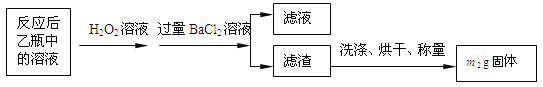
(1)鼓入空气的作用是__________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是_______________(用化学方程式表示)。
H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为__________(列出表达式即可)。
【实验二】:测定铁元素的含量
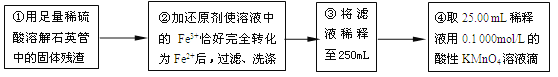
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_______。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =___________。
【答案】(14分)(1) 提供反应物O2,排出装置中生成的SO2使之完全被乙吸收(2分)
(2)Na2SO3+H2O2=Na2SO4+H2O(2分) H2O2![]() H++HO2-(2分)
H++HO2-(2分)
(3)![]() 或
或![]() (2分);(4)偏大(2分)
(2分);(4)偏大(2分)
(5)250mL容量瓶(2分);(6)0.5000mol/L (2分)。
【解析】试题分析:(1)鼓入空气的作用是提供反应物O2,排出装置中生成的SO2使之完全被乙吸收;(2)SO2与NaOH发生反应产生Na2SO3, Na2SO3有还原性,容易被氧化剂氧化为Na2SO4。反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是将Na2SO3氧化为Na2SO4。反应的方程式是:Na2SO3+H2O2=Na2SO4+H2O;H2O2可以看作是一种很弱的酸,其电离方程式是H2O2![]() H++HO2-;(3)根据题意可知:n(S)=(m2÷233g/mol)=m2/233mol;则该黄铁矿石中硫元素的质量分数为[(m2/233mol×32g/mol)÷m1] ×100%=
H++HO2-;(3)根据题意可知:n(S)=(m2÷233g/mol)=m2/233mol;则该黄铁矿石中硫元素的质量分数为[(m2/233mol×32g/mol)÷m1] ×100%=![]() 。(4)②中,若用铁粉作还原剂,则溶液中的Fe2+的物质的量增大,消耗的KMnO4溶液的体积偏多,故使所测得的铁元素的含量偏大;(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250ml的容量瓶;(6)分析表格数据可知低三次实验消耗KMnO4溶液体积误差偏大,应该舍去,则KMnO4溶液的体积平均是(25.00+25.03+24.97)ml÷3=25.00ml。n(KMnO4)=" 0.1" 000mol/L×0.025L=0.0025mol。根据反应方程式:5Fe2++ 8H++MnO4—=5Fe3++Mn2++4H2O可知n(Fe2+)=5n(MnO4—)=0.0125mol;则c(Fe2+)= n(Fe2+)÷V=0.0125mol÷0.025ml=0.5000mol/L。
。(4)②中,若用铁粉作还原剂,则溶液中的Fe2+的物质的量增大,消耗的KMnO4溶液的体积偏多,故使所测得的铁元素的含量偏大;(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250ml的容量瓶;(6)分析表格数据可知低三次实验消耗KMnO4溶液体积误差偏大,应该舍去,则KMnO4溶液的体积平均是(25.00+25.03+24.97)ml÷3=25.00ml。n(KMnO4)=" 0.1" 000mol/L×0.025L=0.0025mol。根据反应方程式:5Fe2++ 8H++MnO4—=5Fe3++Mn2++4H2O可知n(Fe2+)=5n(MnO4—)=0.0125mol;则c(Fe2+)= n(Fe2+)÷V=0.0125mol÷0.025ml=0.5000mol/L。


科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的, W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的沸点:W<Y D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是( )
A.1:2
B.2:1
C.2:3
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA
B.1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA
C.2.0g H218O与D2O的混合物中所含中子数为NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3﹣物质的量浓度大于3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是
①C2H2与C2H4O ②C4H8与C6H12O6③C7H8与C6H12④HCOOCH3与CH3COOH
A. ①③④ B. ①②③④ C. ①④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。然后再将NaHCO3制成Na2CO3。
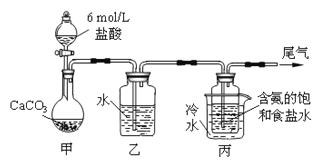
⑴装置乙的作用是__________。为防止污染空气,尾气中含有的_____需要进行吸收处理。
⑵由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有__________。NaHCO3转化为Na2CO3的化学方程式为___________。
⑶若在⑵中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了以下探究。
取加热了t1min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。
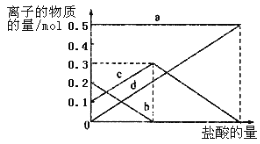
则曲线c对应的溶液中的离子是______(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是_____。
⑷若取21.0 g NaHCO3固体,加热了t2min后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol·L-1的盐酸中则充分反应后溶液中H+的物质的量浓度为_________(设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案合理的是( )
A.用湿润的pH试纸测定某盐溶液的pH
B.用稀硫酸清洗长期存放氯化铁溶液的试剂瓶内壁所附着的不溶物
C.用加热法分离I2和NH4Cl 的混合物
D.为了加更快得到氢气,可以用纯锌代替粗锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应 B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加 D. 电子流向为Zn→导线→Cu→溶液→Zn,形成闭合回路
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com