
配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一提供空轨道的粒子结合。如NH就是由NH3(氮原子提供电子对)和H+(提供空轨道)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是
| A.CO2 | B.H3O+ | C.CH4 | D.[Ag(NH3)2] + |
(1)B D Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4 H2O
(3)①[Co(NH3)5Cl]Cl2 ②: [Co(NH3)4Cl2]Cl
解析试题分析:(1)A.CO2含有极性共价键;错误。B.H3O+含有极性共价键和配位键;正确。 C.CH4含有极性共价键;错误。D.[Ag(NH3)2] +含有极性共价键、配位键。正确。(2)向硫酸铜溶液中滴加氨水,首先发生沉淀反应:Cu2++2NH3·H2O= Cu(OH)2↓+2NH4+,产生蓝色Cu(OH)2沉淀。当氨水过量时发生络合反应:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。沉淀逐渐溶解,变成含有四氨合铜离子的深蓝色溶液。(3)根据题意可知配合物中配离子的配位数均为6,络离子中的Cl-不能与Ag+结合。所以①CoCl3·5NH3的化学式为[Co(NH3)5Cl]Cl2;②CoCl3·4NH3的化学式为: [Co(NH3)4Cl2]Cl。
考点:考查离子方程式的书写及络合物、络离子的性质及化学式的书写的知识。


科目:高中化学 来源: 题型:单选题
二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
| A.S2C12的结构式为Cl—S—S—Cl |
| B.反应中SO2是还原产物,S是氧化产物 |
| C.S2C12为含有极性键和非极性键的分子 |
| D.反应中,生成1molSO2,转移电子为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
过氧化氢(H2O2)俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口及环境、食品消毒;实验室一般用过氧化钡(BaO2)与稀硫酸反应来制取。请问,过氧化钡(BaO2)中所含化学键为
| A.只有离子键 | B.离子键和共价键 |
| C.只有共价键 | D.离子键、共价键和氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分) 按下列要求回答:现有: ①BaCl2;②冰;③NH4Cl;④Na2SO4;⑤干冰;⑥碘片 六种物质。
(1) 属于离子化合物的是__________(填序号,下同),物质中只有离子键的物质有________,
属于共价化合物的是________。
(2) 熔化时不需要破坏化学键的是__________,熔点最低的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
请回答下列问题:
(1)写出铬原子的基态电子排布式________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。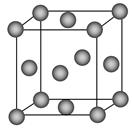
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)确定X、Y两种元素在周期表中的位置。X:____________;Y:____________。
(2)在X和Y两种元素形成的化合物中,写出X的质量分数为50%的化合物的化学式____________;该分子是____________(填“极性”或“非极性”)分子,分子构型为____________。
(3)写出X的质量分数为60%的化合物的化学式________;该分子中,中心原子以________杂化,是____________(填“极性”或“非极性”)分子,分子构型为____________。
(4)由氢、X、Y三种元素形成的常见化合物有两种,其水溶液均呈酸性,试分别写出其分子式____________、____________,并比较酸性强弱____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的原子外围电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38∶77,据上可推知:
(1)X________,Y________,Z________(写元素符号)。
(2)X2Y2是________晶体,构成晶体的微粒是________,该晶体中含有________(填其微粒间作用)。
(3)Z的硫化物和氯化物的分子空间构型分别是__________、________,其中Z原子分别以________、________杂化轨道成键,按照成键方式来分类,Z的硫化物中的共价键类型和数目是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CS2和S2Cl2都是硫的重要化合物,在工业上有广泛的用途。二者的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·cm—3[来源 | 水 |
| CS2 | —110.8 | 46.5 | 1.26 | 难溶 |
| S2Cl2 | —76 | 138 | 1.75 | 水解 |
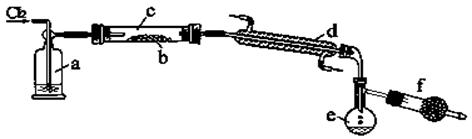
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
最近,美国LawreceLiremore国家实验室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是
A.CO2的原子晶体中存在范德华力,每1molCO2原子晶体中含有2NA 键
键
B.在一定条件下,CO2原子晶体转化为分子晶体CO2是物理变化
C.熔点:金刚石>氯化钠>原子晶体CO2
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com