
| A. | NaOH溶液能导电,所以NaOH溶液是电解质 | |
| B. | 固体KC1不导电,但KC1是电解质 | |
| C. | 氯水能导电,所以Cl2是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
分析 电解质是指:在水溶液里或熔融状态下能导电的化合物,酸、碱、盐、部分有机物、金属氧化物都是电解质,单质、混合物都不是电解质.
解答 解:A.NaOH溶液是混合物,所以不是电解质,故A错误;
B.固体KC1不导电,碳在水溶液里或熔融状态下能导电,所以KC1是电解质,故B正确;
C.Cl2是单质不是化合物,所以Cl2不是电解质,故C错误;
D.二氧化碳溶于水生成碳酸,碳酸电离出自由移动的阴阳离子而使其溶液导电,但阴阳离子是碳酸电离的而不是二氧化碳电离的,所以碳酸是电解质,二氧化碳是非电解质,故D错误;
故选:B.
点评 本题考查电解质的判断,题目简单,注意:电解质是化合物,单质和混合物既不是电解质 也不是非电解质;电解质必须是本身能电离的化合物.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
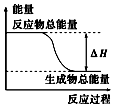
| A. | 铝粉与氧化铁在加热条件下的反应 | |
| B. | 灼热的碳与二氧化碳反应 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 碳与水高温条件下制取水煤气的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) mol | 0.200 | c1 | 0.10 | c3 | a | b |
| n(NO2) mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量Al3+的无色溶液中:Cu2+、Na+、Cl-、SO42- | |
| B. | 在含有大量H+的溶液中:Na+、K+、CO32-、NO3- | |
| C. | 在强酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液与Ba (OH)2溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | NaHSO4溶液和NaHCO3溶液反应:H++HCO3-═H2O+CO2↑ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 往BaCl2溶液中通入少量的SO2:Ba2++SO2+H2O═BaSO3↓+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com