
| A. | 浓硝酸和硝酸银用棕色试剂瓶保存 | |
| B. | 常温下铁和铂都不溶于浓硝酸 | |
| C. | 亚硫酸盐和硫酸亚铁固体长期暴露在空气中变质 | |
| D. | H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率 |
分析 A.浓硝酸见光易分解;硝酸银见光会分解;
B.常温下铁遇浓硝酸,发生钝化;铂的活泼性较弱,与浓硝酸不反应;
C.亚铁离子具有还原性,易被空气中的氧气氧化而变质;亚硫酸盐具有还原性,易被空气中的氧气氧化而变质;
D.催化剂能加快H2O2的分解速率.
解答 解:A.浓硝酸见光易分解,须存放在棕色瓶中;硝酸银见光会分解,应盛放在棕色瓶中,能用同一原理解释,故A不选;
B.常温下铁遇浓硝酸,发生钝化;铂的活泼性较弱,与浓硝酸不反应,不能用同一原理解释,故B选;
C.亚铁离子具有还原性,易被空气中的氧气氧化而变质;亚硫酸盐具有还原性,易被空气中的氧气氧化而变质,能用同一原理解释,故C不选;
D.催化剂能加快H2O2的分解速率,MnO2或FeCl3溶液都能作H2O2分解的催化剂,能用同一原理解释,故D不选;
故选B.
点评 本题考查了元素化合物的性质,题目难度不大,注意把握常见物质的性质以及物质的保存方法,侧重于考查学生对基础知识的应用能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式-COH | |
| B. | 2-乙基-1,3-丁二烯分子的键线式: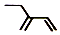 | |
| C. | 比例模型 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 四氯化碳分子的电子式: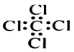 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72L | B. | 7.84L | C. | 10.08L | D. | 13.44L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL 0.1 mol/L盐酸中,含有HCl分子数目为0.05NA | |
| B. | 0℃、1个标准状况下,22.4LNO和22.4LO2混合后所得气体中分子总数为1.5NA | |
| C. | 常温下.0.5 moll•L-l Fe3(SO4)2溶液中含 Fe3+数目为1NA | |
| D. | 在标准状况下,22.4 LCH4与18 g H2O所含有的质子数、电子数均为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸应保存在配橡胶塞的棕色细口瓶里 | |
| B. | 铵态氮肥不宜与碱性肥料混合施用 | |
| C. | NH3能发生氧化还原反应进而生产硝酸 | |
| D. | 氮氧化物也是形成酸雨的污染物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的单质硅可用于制作计算机芯片 | |
| B. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| C. | 二氧化硫不可用作熏蒸粉丝 | |
| D. | 碳酸钠可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
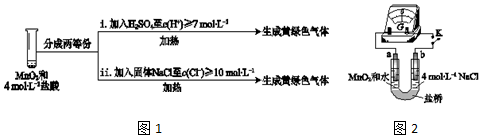
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com