
| A. | 海水蒸发→云→降水,这是地球水循环的过程,该过程主要是物理变化 | |
| B. | 海水中所含的常量元素大部分以盐的形式存在,其中含量最高的盐是氯化钠 | |
| C. | 海洋是化学元素的集散地,元素周期表所有的元素在海水中都能找到 | |
| D. | 由海水制备镁、氯、溴、碘等单质均需要涉及氧化还原反应 |
分析 A.化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成,据此分析判断;
B.根据海水中所含成分解答;海水中的化学元素种类较多,绝大多数是以盐类离子的形式存在;
C.海洋是化学元素的集散地,元素周期表所有的元素大多数能在海水中能找到,但不是全部;
D.由海水制备镁,是镁离子被还原成镁单质的过程,海水中提取氯、溴、碘,是把氯、溴、碘离子氧化为单质的过程.
解答 解:A.海水蒸发→云→降水,只是水的状态发生改变,没有新物质生成,故A正确;
B.海水中含有多种无机盐,常量元素大部分以盐的形式存在,其中含量最高的是氯化钠,化学式为NaCl,故B正确;
C.海水中含有的化学元素有80多种,元素周期表中已经发现的元素有113种,故C错误;
D.由海水制备镁采用电解无水MgCl2,镁离子被还原成镁单质,电解氯化钠溶液2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,提取氯单质,提取溴反应方程式为:Cl2+2Br-=2Cl-+Br2,提取碘:2I-+Cl2=I2+2Cl-,由海水制备镁、氯、溴、碘等单质均需要涉及氧化还原反应,故D正确;
故选C.
点评 本题考查海水中的化学元素,掌握钠、镁、氯、溴、碘等元素的性质是解答关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、纤维素均为高分子有机物 | |
| B. | 酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖溶液 | |
| D. | 分子 所有碳原子一定不能共平面 所有碳原子一定不能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .K在周期表的位置是第四周期ⅠA;25Mn属于ⅦB或副族族元素.
.K在周期表的位置是第四周期ⅠA;25Mn属于ⅦB或副族族元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
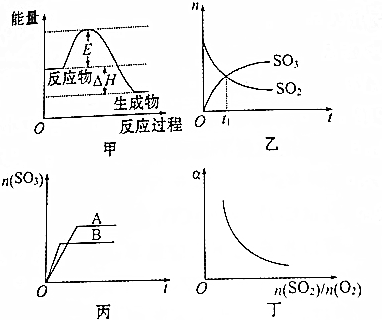
| A. | 加入适当的催化剂后,甲图中的E和△H都减小 | |
| B. | 乙图中t1时刻反应达到化学平衡状态 | |
| C. | 丙图可以表示其他条件不变时,压强对反应的影响 | |
| D. | 丁图中a可以表示SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
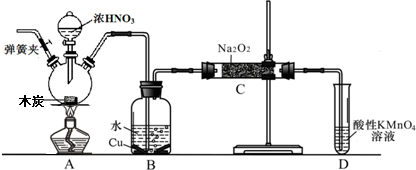
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol | B. | 0.15mol | C. | 0.1mol | D. | 0.075mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、CO32- | B. | NH4+、Mg2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、Cl- | D. | Na+、K+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5 mol•L-1 亚硫酸溶液中含有的H+数为2NA | |
| C. | 分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA | |
| D. | 1mol FeI2与足量氯气反应时转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com