
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
(2)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应;
(3)根据碳酸钠加热不分解,碳酸氢钠加热分解得到碳酸钠、水、二氧化碳来解答,铝是活泼金属在空气中表面形成氧化铝保护膜;
(4)根据n=$\frac{V}{{V}_{m}}$结合分子的构成计算.
(5)根据n=$\frac{m}{M}$计算Fe3+的物质的量,溶液中2n(SO42-)=3n(Fe3+),再根据c=$\frac{n}{V}$计算SO42-的物质的量浓度;
(6)胶体加入电解质会发生聚沉;
(7)电解质溶液导电能力强弱取决于离子浓度的大小,氨水中加入盐酸依据反应物和生成物的性质判断离子浓度的变化进而判断导电能力变化;
解答 解:(1)①液态氯化氢在水溶液中能导电,是电解质;
②NaHCO3在水溶液或者熔融状态下能够导电,是电解质;
③固体纯碱在水溶液或者熔融状态下能够导电,是电解质;
④二氧化碳水溶液中反应生成电解质溶液导电,本身不能电离属于非电解质;
⑤葡萄糖在水溶液和熔融状态下都不能够导电,是非电解质;
⑥氢氧化钾在水溶液或者熔融状态下能够导电,是电解质;
⑦氢氧化铁胶体属于混合物 既不是电解质也不是非电解质;
⑧氨水属于混合物 既不是电解质也不是非电解质;
⑨Al 属于单质能导电,既不是电解质也不是非电解质;
⑩硫酸铁溶液属于混合物 既不是电解质也不是非电解质;
故属于电解质的是:①②③⑥,非电解质的有:④⑤;
故答案为:①②③⑥;④⑤;
(2)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应,如HCl+KOH=H2O+KCl;
故答案为:HCl+KOH=H2O+KCl;
(3)根据碳酸钠加热不分解,碳酸氢钠加热分解得到碳酸钠、水、二氧化碳,所以除去固体纯碱中少量小苏打的操作是加热,方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,⑨在空气中能稳定存在的原因是铝化学性质非常活沷,容易与空气中的氧气发生反应形成一层致密的氧化膜,阻止里面的铝继续与氧气反应,
故答案为:加热;铝化学性质非常活沷,容易与空气中的氧气发生反应形成一层致密的氧化膜,阻止里面的铝继续与氧气反应;
(4)n(CO2)=$\frac{1}{2}$n(O)=0.2mol,V(CO2)=0.2mol×22.4L/mol=4.48L;
故答案为:4.48;
(5)Fe3+的物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,溶液中2n(SO42-)=3n(Fe3+),则SO42-的物质的量为0.1mol×$\frac{3}{2}$=0.15mol,SO42-的物质的量浓度为$\frac{0.15mol}{0.1L}$=1.5mol/L;
故答案为:1.5mol/L;
(6)若在氢氧化铁胶体中缓慢加入氢氧化钾,胶体发生聚沉,产生的现象是产生红褐色沉淀;
故答案为:产生红褐色沉淀;
(7)将①液态氯化氢加入到⑥氢氧化钾 的溶液中,⑥的溶液导电能力变化基本不变,
故答案为:基本不变;
点评 本题考查了物质导电的条件,电解质和非电解质的概念,胶体的性质,离子方程式书写,物质的量有关计算等,题目综合性强,氢氧化铁胶体性质的考查是本题的难点,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
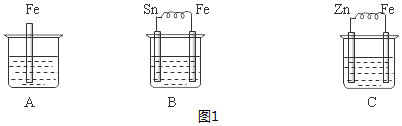
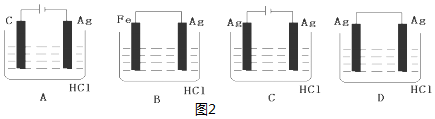
| A. | ③⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑥⑦⑨ | D. | ③⑤⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

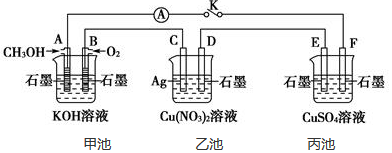
| A. | 甲中负极反应式为Ag++e-═Ag | |
| B. | 丙中H+向碳棒方向移动 | |
| C. | 乙中阳极反应式为2H++2e-═H2↑ | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
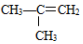 ②
②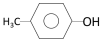 ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( )
;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( )| A. | 4类 | B. | 5类 | C. | 6类 | D. | 7类 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:推断题
下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。 反应①②均为工业上的重要反应。
反应①②均为工业上的重要反应。

请回答下列问题:
(1)D的电子式为__ ___。
(2)K的化学式为___ ___。
(3)写出B与C高温反应生成E和F的化学方程式:___ __。
(4)写出D与J的稀溶液反应生成G的离子方程式:__ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com