
| n(H2O) |
| n(CO2) |


| n(H2O) |
| n(CO2) |
| 1 |
| c(CO2)c2(NH3) |
| 1 |
| c(CO2)c2(NH3) |
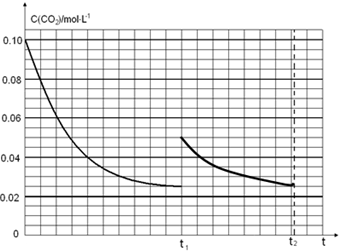 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:

| A、用图1 所示装置除去Fe(OH)3胶体中含有的少量FeCl3杂质 |
| B、用图2 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C、用图3 所示装置从海水制取蒸馏水 |
| D、用图4 所示装置分离酒精萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 L铁与足量盐酸反应转移的电子数0.3NA |
| B、标准状况下,22.4 L水中含有NA个水分子 |
| C、常温常压下,48 g O2含有的氧原子数为3NA |
| D、标准状况下,22.4 L氦气与22.4 L氢气所含原子数均为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LCHCl3含有的分子数为0.1NA |
| B、2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| C、0.1molCnH2n+2中含有的C-C键数为0.1nNA |
| D、1mol苯乙烯中含有的C=C数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 选项的标号 |
| 除去FeSO4溶液中的Fe2(SO4)3 | |
| 从碘水中提取碘单质 | |
| 提纯混有少混NaCl的KNO3 | |
| 鉴别NaCl和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NH4+、OHˉ |
| B、Na+、Ba2+、SO42ˉ |
| C、SO42-、Mg2+、NH4+ |
| D、Clˉ、Fe3+、Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com