
| A.可由PH3与HI化合生成 | B.将其加热可以分解 |
| C.能跟NaOH溶液反应 | D.是一种共价化合物 |
科目:高中化学 来源:不详 题型:填空题

 NF3+3NH4F
NF3+3NH4F
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| H | | | | | | | He |
| 1.3120 | | | | | | | 0.3723 |
| Li | Be | B | C | N | O | F | Ne |
| 0.5203 | 0.8995 | 0.8001 | 1.0864 | 1.4023 | 1.3140 | 1.6810 | 2.0807 |
| Na | Mg | Al | Si | P | S | Cl | Ar |
| 0.4958 | 0.7377 | 0.5776 | 0.7865 | 1.0118 | 0.9996 | 1.2511 | 1.5205 |
| K | Ca | Ga | Ge | As | Se | Br | Kr |
| 0.4189 | 0.5898 | 0.5788 | | 0.9440 | 0.9409 | 1.1399 | 1.3507 |
| Rb | Sr | In | Sn | Sb | Te | I | Xe |
| 0.4030 | 0.5495 | 0.5583 | 0.7086 | 0.8316 | 0.8693 | 1.0084 | 1.1704 |
| Cs | Ba | Tl | Pb | Bi | Po | At | |
 表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用
表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用 表示)的位置。
表示)的位置。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所有的原子核内质子数都比中子数多 |
| B.氢离子(H+)实质上是一个裸露的质子 |
| C.核外电子排布相同的微粒,其化学性质也相同 |
| D.非金属元素原子最外层电子数都大于4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子间形成的氢键使物质的熔点和沸点升高; |
| B.冰中存在氢键,水中不存在氢键; |
| C.每一个水分子内含有两个氢键; |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B.P4和CH4都是正四面体分子且键角都为109o28ˊ |
| C.CsCl晶体中与每个Cs+距离相等且最近的Cl-共有8个 |
| D.原子晶体的熔沸点一定比金属晶体的高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.(水晶)SiO2 | B.冰醋酸 | C.氧化镁 | D.白磷 E.固体氩 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


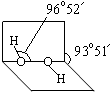
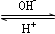 R(OH)3
R(OH)3 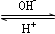 [R(OH)4]-
[R(OH)4]-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com