


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、金属原子只有还原性,金属阳离子只有氧化性 |
| B、金属单质在常温下都是固体 |
| C、金属阳离子被还原不一定得到金属单质 |
| D、含金属元素的离子都是阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
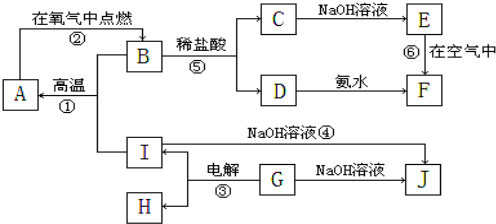
科目:高中化学 来源: 题型:
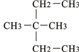 ③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥37 17 |
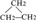 ⑧氯气 ⑨CH3CH2OH ⑩臭氧?
⑧氯气 ⑨CH3CH2OH ⑩臭氧?35 17 |
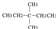 ?CH≡CH?
?CH≡CH?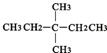 ?H2
?H2查看答案和解析>>
科目:高中化学 来源: 题型:
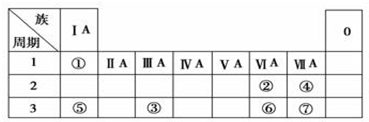
查看答案和解析>>
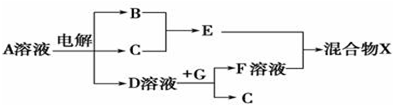
科目:高中化学 来源: 题型:
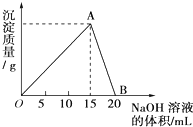 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com