
【题目】硼及其化合物广泛应用于能源、材料等领域。
(1)钕铁硼是磁性材料,被称为“磁王”。钕的价电子排布式为4f46s2,则钕原子的未成对电子数有__个。
(2)氟化硼(BF3)是石油化工的重要催化剂。BF3BF3是__分子(填“极性”或“非极性”),BF3中B—F比BF4-中B—F的键长短,原因是__。
(3)乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。
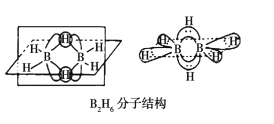
①B2H6的分子结构如图所示,其中B原子的杂化方式为__。
②H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__。
③同一周期中,第一电离能介于B、N之间的元素有__种。
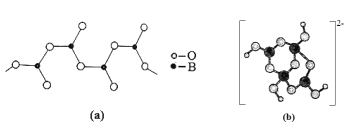
(4)硼酸盐是重要的防火材料。图(a)是一种无限链式结构的硼酸根,则该硼酸根离子符号是__,图(b)是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
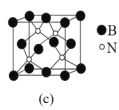
(5)立方氮化硼(BN)是超硬、耐磨、耐高温的新型材料。其晶体结构与金刚石相似,如图c所示,则B的配位数为__,测得B与N的原子核间距为anm,晶体的密度为dg·cm-3,则阿伏加德罗常数NA=__(列计算式即可)。
【答案】4 非极性 BF3中B采用sp2杂化,BF4-中B采用sp3杂化,s轨道成分越多,电子云重叠程度越大,键长越短[或BF3中除了σ键,还有(π![]() )大π键] sp3杂化 H3NBH3分子间存在(双)氢键,分子间作用力更大 3 [BO2]
)大π键] sp3杂化 H3NBH3分子间存在(双)氢键,分子间作用力更大 3 [BO2]![]() 或BO2- ABD 4
或BO2- ABD 4  或
或![]()
【解析】
F能级有7个轨道,BF3中B的价电子对数为![]() ;乙硼烷分子中每个硼原子含有4个共价键;氢键使分子间作用力更大;根据(4)图可知,一个B原子与3个O原子连接,但有2个O原子是与其他B原子共用的;根据晶胞结构可知,B原子位于晶胞的顶点和面心,N原子为体内。
;乙硼烷分子中每个硼原子含有4个共价键;氢键使分子间作用力更大;根据(4)图可知,一个B原子与3个O原子连接,但有2个O原子是与其他B原子共用的;根据晶胞结构可知,B原子位于晶胞的顶点和面心,N原子为体内。
(1)f能级有7个轨道,根据钕的价电子排布式为4f46s2,4个电子分别占在4个不同的轨道,自旋相同,则钕原子的未成对电子数有4个。
(2)因BF3中B的价电子对数为![]() ,B采取sp2杂化,则BF3空间构型为平面三角形,是对称结构,故BF3是非极性分子;BF3中未杂化的2pz轨道与F的2pz轨道平行重叠形成大π键,故BF3中B—F比BF4-中B—F的键长短。
,B采取sp2杂化,则BF3空间构型为平面三角形,是对称结构,故BF3是非极性分子;BF3中未杂化的2pz轨道与F的2pz轨道平行重叠形成大π键,故BF3中B—F比BF4-中B—F的键长短。
(3)①乙硼烷分子中每个硼原子含有4个共价键,所以B原子采用sp3杂化;
②H3NBH3中与N连接的H显正电性,与B连接的H显负电性,形成双氢键,分子间作用力更大,故H3NBH3的沸点却比B2H6高得多。
③同一周期中,第一电离能介于B、N之间的元素有Be、C、O,共3种。
(4)一个B原子与3个O原子连接,但有2个O原子是与其他B原子共用的,故硼酸根离子符号是[BO2]![]() 或BO2-;根据图(b)可知,硼酸钠晶体中钠离子与硼酸根离子间为离子键硼原子与氧原子形成极性键,同时存在配位键。
或BO2-;根据图(b)可知,硼酸钠晶体中钠离子与硼酸根离子间为离子键硼原子与氧原子形成极性键,同时存在配位键。
(5)晶立方氮化硼体结构与金刚石相似,N形成4个共价键,则B的配位数为4;根据均摊法可计算出晶胞中硼原子数为![]() ,N原子数为4,则晶胞的质量为
,N原子数为4,则晶胞的质量为![]() ,将晶胞分割成8个小立方体,则体对角线为2anm,得出该晶体的体对角线为4anm,设晶胞参数为xnm,则有4a=
,将晶胞分割成8个小立方体,则体对角线为2anm,得出该晶体的体对角线为4anm,设晶胞参数为xnm,则有4a=![]() x,x=
x,x=![]() , 根据
, 根据![]() ,得d=
,得d=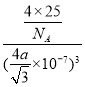 ,则NA=
,则NA= 。
。


科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是_______、_______。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是_______。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_______mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到_______克固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
A. 生成44.8L N2(标准状况)
B. 有0.25 mol KNO3被还原
C. 转移电子的物质的量为1.75mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素互化物如ICl、ICl3等具有与卤素单质相似的性质。利用反应I2+Cl2=2ICl,实验室可用如图所示装置(夹持仪器已略去)制取少量ICl3。已知:ICl的熔点为27.2℃,沸点为97.40C,容易水解,能发生反应:ICI+C12=IC13。下列叙述错误的是( )
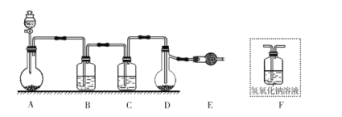
A.圆底烧瓶中的固体可以为KMnO4或KClO3
B.装置B、C中的试剂分别为饱和食盐水和浓硫酸
C.装置E的作用为吸收尾气,可用装置F替代
D.盐酸的滴加速度过快,ICl的产率会明显降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g) ![]() N2O2(g) (快) △H1<0 平衡常数K1
N2O2(g) (快) △H1<0 平衡常数K1
②N2O2(g)+O2(g) ![]() 2NO2(g) (慢) △H2<0 平衡常数K2
2NO2(g) (慢) △H2<0 平衡常数K2
下列说法正确的是
A.2NO(g)+O2(g) ![]() 2NO2(g) △H=-(△H1-△H2)
2NO2(g) △H=-(△H1-△H2)
B.2NO(g)+O2(g) ![]() 2NO2(g)的平衡常数
2NO2(g)的平衡常数![]()
C.反应过程中的能量变化可用如图表示
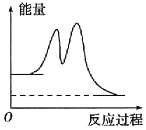
D.反应②的速率大小决定2NO(g)+O2(g) ![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2—二溴乙烷[BrCH2CH2Br,常温下为无色液体,难溶于水,密度比水大,熔点9℃,沸点132℃]常用作熏蒸消毒的溶剂。利用以下原理可在实验室制取:2C2H5OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br。
BrCH2CH2Br。
已知:140℃时发生副反应生成乙醚(C2H5OC2H5),局部过热会生成SO2、CO2。
实验步骤如下:
①按如图组装仪器(夹持装置略),检查气密性后添加试剂。
②在冰水浴冷却、搅拌下,将20mL浓硫酸缓慢加到10mL95%乙醇中,取出5mL混合液加入三颈烧瓶中,将剩余部分移入恒压滴液漏斗。
③加热A至175℃,打开恒压滴液漏斗活塞,慢慢滴加混合液至D中液溴反应完全。
④将D中产物移到分液漏斗,依次用水、NaOH溶液、水洗涤并分液,往有机相加入适量MgSO4固体,过滤、操作Y,收集到BrCH2CH2Br4.23g。

请回答以下问题:
(1)B中长导管的作用是___。
(2)试剂X可选用___(填序号)。
a.NaOH溶液 b.饱和NaHSO3溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(3)D中具支试管还需加入少量水,目的是___。反应过程中需用冷水冷却具支试管,若将冷水换成冰水,可增强冷却效果,但主要缺点是___。
(4)步骤②配制混合液使用的玻璃仪器除了量筒,还有___。
(5)与直接将全部混合液加热到170℃相比,步骤③中往175℃少量混合液中慢慢滴加混合液,最主要的优点是___。
(6)反应结束后,E中溶液检测到BrO3-,则E中发生反应的离子方程式为___。
(7)步骤④操作Y为___。
(8)BrCH2CH2Br的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物CH3﹣CH=CH﹣C≡C﹣CF3分子结构的叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.有5个碳原子可能在一条直线上
C.6个碳原子一定都在同一平面上
D.6个碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是

A. 二者物质的量之比为3∶2
B. 二者质量之比为3∶2
C. 二者摩尔质量之比为2∶3
D. 二者消耗H2SO4的物质的量之比为2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com