
| A、凡是放热反应都是自发的,吸热反应都是非自发的 |
| B、某反应△H=-122KJ?mol-1,△S=231J?mol-1?k -1,此反应任何温度下都不能自发进行 |
| C、活化分子之间发生的碰撞不一定为有效碰撞 |
| D、对有气体参加的化学反应,减小体积增大体系压强,可使单位体积内活化分子数增加,因而反应速率增大 |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
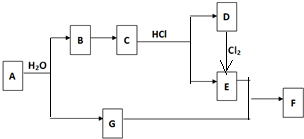
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将0.2 mol?L-1的NH4Al(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++H2O2+2H+=Fe3++2H2O |
| D、将大理石投入到足量盐酸中:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HClO3>H2SO4>H2SiO3>H3PO4 |
| B、沸点:HF>HCl>HBr>HI |
| C、热稳定性:HF>HCl>HBr>HI |
| D、碱性:Ca(OH)2>KOH>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓盐酸挥发,浓度不足 |
| B、配制溶液时,未洗涤烧杯 |
| C、配制溶液时,俯视容量瓶刻度线 |
| D、加水时超过刻度线,用胶头滴管吸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下22.4 L H2 中含中子数2NA |
| B、3.2gCu与10.0g98%硫酸溶液反应可得到0.05NA个SO2分子 |
C、0.1mol  中含有的电子总数为0.9NA 中含有的电子总数为0.9NA |
| D、常温常压下,8gCH4含有共用电子对数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将等体积的甲烷与氯气混合于一试管中并倒置于水槽里,置于光亮处.下列有关此实验所观察到的现象或结论中,不正确的是( )
将等体积的甲烷与氯气混合于一试管中并倒置于水槽里,置于光亮处.下列有关此实验所观察到的现象或结论中,不正确的是( )| A、瓶中气体的黄绿色逐渐变浅 |
| B、瓶内壁有油状液滴形成 |
| C、此反应的生成物只有四种 |
| D、试管中液面上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:Na+>Mg2+>Al3+>Cl- 原子半径:Na>Mg>Al>Cl |
| B、稳定性:HF>H2O>NH3>CH4 还原性:HF<H2O<NH3<CH4 |
| C、碱性:CsOH>KOH>Mg(OH)2>NaOH 金属性:Cs>K>Mg>Na |
| D、氧化相同物质的量I-生成I2,需要氧化剂的物质的量 MnO4->H2O2>O3>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、直线形;三角锥形 |
| B、V形;三角锥形 |
| C、直线形;平面三角形 |
| D、V形;平面三角形 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com