
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O-+CO32-═H2CO3+2HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
分析 分析图表中的电离平衡常数判断电离程度大小,
碳酸存在电离平衡H2CO3?HCO3-+H+,K1=4×10-7,HCO3-?H++CO32- K2=5.6×10-11,
亚硫酸存在电离平衡 H2SO3?HSO3-+H+,K1=1.54×10-2,HSO3-?H++SO32- K2=1.02×10-7,
碳酸与亚硫酸都是弱酸,电离平衡常数越大,酸性越强,酸性强弱为:H2SO3>H2CO3>HSO3->HCO3-,发生化学反应应遵循强酸制备弱酸的原理,以此分析选项中的产物是否正确.
解答 解:A.H2SO3>HCO3-,符合强酸制弱酸,故A合理;
B.H2CO3可与SO32-反应得到HSO3-,故B不合理;
C.H2CO3与HSO3-能共存,故C合理;
D.HCO3-与HSO3-能共存,故D合理.
故选ACD.
点评 本题目考查了离子反应发生的条件和弱电解质电离程度大小,其中电离平衡常数比较酸性强弱,强酸制弱酸的分析方法是本题的解题关键,题目难度是中等.


科目:高中化学 来源: 题型:选择题
| A. | 该反应中Cu2S只是还原剂 | |
| B. | 每生产1molCu需转移2mol电子 | |
| C. | 该反应中SO2既是氧化产物又是还原产物 | |
| D. | 若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| C. | 盐:胆矾、小苏打、铜绿 | |
| D. | 无丁达尔现象的分散系:碘的四氯化碳溶液、淀粉溶液、氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、O-H键为463,则断裂1mol N-H键所需的能量是( )
有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、O-H键为463,则断裂1mol N-H键所需的能量是( )| A. | 658 | B. | 516 | C. | 391 | D. | 194 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
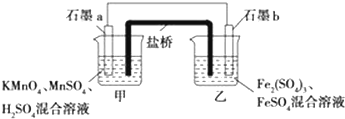
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com