
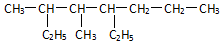 ��ϵͳ����Ϊ3��4-����-5-�һ����飮������������ijȲ����H2�����ӳɷ�Ӧ���õ��IJ������������Ȳ��������4�֣�
��ϵͳ����Ϊ3��4-����-5-�һ����飮������������ijȲ����H2�����ӳɷ�Ӧ���õ��IJ������������Ȳ��������4�֣� ������һ���л���X�ļ���ʽ��ͼ��ʾ��
������һ���л���X�ļ���ʽ��ͼ��ʾ��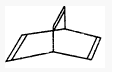
 ��
�� ��
�� ���� ��1���л���������8��Cԭ�ӣ�����2������1���һ�������������ijȲ����H2�����ӳɷ�Ӧ���õ��IJ���ɽ��C�γ�4�����ۼ��ж�������λ�ã�
��2�����ɽṹ��ʽ��֪�л������ʽΪC8H8��1mol��������10mol������
���л���Y��X��ͬ���칹�壬�����ڷ����廯���������ˮ�����ӳɷ�Ӧ��ӦΪ����ϩ�����б�����̼̼˫������Ϊƽ���νṹ������̼̼˫�����ɷ����Ӿ۷�Ӧ���ɾۺ��
�������麬��8��Hԭ�ӣ�������ȡ�����ͬ���칹�������ȡ�����ͬ���칹����Ŀ��ͬ��M��һ������Ԫ����ƽ����ӣ�̼̼֮���ǵ���˫������ṹ���Դ˿�ȷ���ṹ��ʽ��
��� �⣺��1���л���������8��Cԭ�ӣ�����2������1���һ�������Ϊ3��4-����-5-�һ����飻����������ijȲ����H2�����ӳɷ�Ӧ���õ��IJ����C�γ�4�����ۼ����ж�������λ����4�֣�����������Ȳ��������4�֣�̼̼�����ӳɿ�����-CH2-CH3��-CH2-CH2-�ṹ��
�ʴ�Ϊ��3��4-����-5-�һ����飻4��
��2�����ɽṹ��ʽ��֪�л������ʽΪC8H8��1mol��������10mol���������Ϊ224L���ʴ�Ϊ��C8H8��224��
���л���Y��X��ͬ���칹�壬�����ڷ����廯���������ˮ�����ӳɷ�Ӧ��ӦΪ����ϩ������ˮ��Ӧ�Ļ�ѧ����ʽΪC6H5-CH=CH2+Br2��C6H5-CHBr-CH2Br�����б�����̼̼˫������Ϊƽ���νṹ������ӽṹ������ԭ�ӿ�����ͬһƽ���ڣ�����ϩ�������������·����ӳɷ�Ӧ���ɾ۱���ϩ���������ǼӾ۷�Ӧ���÷�ӦΪ ��
��
�ʴ�Ϊ��C6H5-CH=CH2+Br2��C6H5-CHBr-CH2Br���ǣ� ��
��
��������Ķ��ȴ����ͬ���칹��ֱ��ǣ�һ���⡢��Խ��ߡ���Խ����ϵ�������ԭ�ӱ���ԭ�Ӵ��棬���Զ��ȴ����ͬ���칹�������֣�����ȡ�����ͬ���칹�������ȡ�����ͬ���칹����Ŀ��ͬ��ҲΪ3�֣�M��һ������Ԫ����ƽ����ӣ�̼̼֮���ǵ���˫������ṹ����ṹ��ʽΪ ��
��
�ʴ�Ϊ��3�� ��
��
���� ���⿼���л���Ľṹ�����ʣ�Ϊ��Ƶ���㣬���չ����������ʵĹ�ϵΪ���Ĺؼ��������л�ͬ���칹�弰�л���Ӧ����ʽ��д�Ŀ��飬ע�ⷴӦ���͵��жϣ���Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
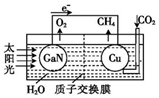 ��ѧ���õ����ز�����ͭ��װ��ͼ��ʾ�˹����ϵͳ�����ø�װ�óɹ���ʵ������CO2��H2O�ϳ�CH4������˵������ȷ���ǣ�������
��ѧ���õ����ز�����ͭ��װ��ͼ��ʾ�˹����ϵͳ�����ø�װ�óɹ���ʵ������CO2��H2O�ϳ�CH4������˵������ȷ���ǣ�������| A�� | �ù����ǽ�̫����ת��Ϊ��ѧ�ܵĹ��� | |
| B�� | GaN���淢��������Ӧ��2H2O-4 e-�TO2��+4H+ | |
| C�� | Cu����ķ�Ӧ�ǣ�CO2+8e-+6H2O�TCH4+8OH? | |
| D�� | H+�����ӽ���Ĥ��������Ǩ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ƥ���ϲ���մ��ŨNa OH��Һ��������ϡ�����ϴ | |
| B�� | ��������й©ʱ��ӦѸ���뿪�ֳ������������ߴ�ȥ | |
| C�� | ���������ľƾ��������Ż�ʱ�������ô���ˮ���� | |
| D�� | �������Ż�ʱ��Ӧ������մˮ��ë������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ��Ag��H2S���ǻ�ԭ��������������Ӧ | |
| B�� | �����鶾ʱ�������е�����ʧȥ���� | |
| C�� | X�Ļ�ѧʽΪAg2S����ɫΪ��ɫ��ͨ���۲�������ɫ�仯���ж������Ƿ��ж� | |
| D�� | ÿ����1mo1X����Ӧת��4mo1 e- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ӳ� | B�� | ���Ӳ���ܼ� | ||
| C�� | ���Ӳ㡢�ܼ���ԭ�ӹ���ռ�ֲ� | D�� | ԭ�ӹ���ռ�ֲ��͵����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������м���ϡ���Ba2++OH-+SO42-+H+�TBaSO4��+H2O | |
| B�� | ������ʯͶ�뵽���������У�CO32-+2H+�TCO2��+H2O | |
| C�� | ���������Һ��ͨ������������̼��Ca2++2ClO-+H2O+CO2�TCaCO3��+2HClO | |
| D�� | ����þ��Һ������������Һ��Ӧ��SO42-+Ba2+�TBaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
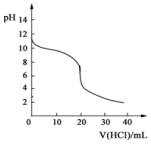 �����£���20.00mL0.1000mol•L-1�İ�ˮ����μ���0.1000mol•L-1�����ᣬpH����������ı仯��ͼ��ʾ����������NH3���ݳ���������˵������ȷ���ǣ�������
�����£���20.00mL0.1000mol•L-1�İ�ˮ����μ���0.1000mol•L-1�����ᣬpH����������ı仯��ͼ��ʾ����������NH3���ݳ���������˵������ȷ���ǣ�������| A�� | ��Ӧ�����У�c��NH4+��+c��H+��=c��OH-��+c��Cl-�� | |
| B�� | V��HCl��=10.00mLʱ��c��NH4+����c��Cl-����c��NH3•H2O�� | |
| C�� | V��HCl����20.00mLʱ����Һһ���ʼ��� | |
| D�� | V��HCl��=30.00mLʱ��2c��Cl-��=3c��NH4+��+3c��NH3•H2O�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
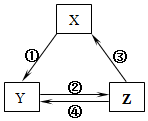 �����и��������У�����֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾת����������Ӧ������ȷ���ǣ�������
�����и��������У�����֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾת����������Ӧ������ȷ���ǣ�������| ѡ�� | X | Y | Z | ��ͷ���������ֵķ�Ӧ���� |
| A | SiO2 | Na2SiO3 | H2SiO3 | ����Na2CO3���� |
| B | Na | Na2O2 | NaCl | �ڼ�H2O |
| C | NO | NO2 | HNO3 | ����C���� |
| D | Al2O3 | NaAlO2 | Al��OH��3 | ����NaOH |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com