
【题目】氯化铁是黑棕色晶体,沸点为315℃,有强烈的吸水性,易潮解。某小组同学对无水FeCl3能否分解产生Cl2,进行了如下实验探究。
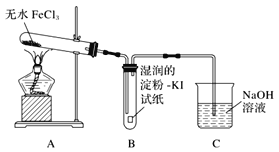
(1)甲同学认为装置B中湿润的淀粉KI试纸变蓝即可证明无水FeCl3能分解产生Cl2,乙同学认为不能得出此结论,理由是_______。
(2)乙同学提出了改进意见,用如图所示装置进行实验:
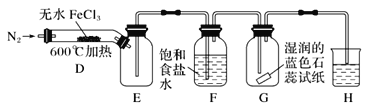
装置H中的试剂为________。装置F中饱和食盐水的作用是________。实验结束后,取装置D中残留固体溶于稀盐酸中,向所得溶液中加入_________(填化学式)溶液,若观察到_____,说明FeCl3已经分解完全。
(3)实验后把镁条投入装置F的溶液中,发生的现象是___,其原因是(结合离子方程式)解释_______。
【答案】该实验条件下能将I-氧化为I2的物质,除了无水FeCl3分解产生的Cl2外,还有装置中的氧气,以及沸点较低的FeCl3受热变成的FeCl3蒸气 NaOH溶液 除去FeCl3蒸气 KSCN 溶液未变红色 有气泡和红褐色沉淀产生 Fe3+水解:Fe3++3H2O![]() Fe(OH)3+3H+,Mg与H+反应,Mg+2H+=Mg2++H2↑产生氢气,pH升高,促进Fe3+完全水解,生成Fe(OH)3沉淀
Fe(OH)3+3H+,Mg与H+反应,Mg+2H+=Mg2++H2↑产生氢气,pH升高,促进Fe3+完全水解,生成Fe(OH)3沉淀
【解析】
该小组同学对无水FeCl3能否分解产生Cl2,进行试验探究,甲同学想通过装置B中湿润的淀粉KI试纸变蓝来证明无水FeCl3能分解产生Cl2,他认为的原理是: Cl2有氧化性,会把I-氧化为I2,I2遇到淀粉显蓝色。但是在第一套装置中,有氧化性的除了氯气还有空气中的氧气,以及沸点较低的FeCl3受热变成的FeCl3蒸汽,他们都可以把I-氧化为I2。这样看来,第一套装置不够严密,可以从上述角度出发来改进装置,即乙同学改进的装置。通入N2可以排出装置内的空气,避免氧气的干扰,E是安全瓶,F可以吸收FeCl3蒸气,G用来检验氯气,若出现湿润的淀粉KI试纸变蓝即可证明无水FeCl3能分解产生Cl2,H是尾气处理装置,可以用NaOH溶液吸收氯气。判断FeCl3是否完全分解,可以通过检验Fe3+来检验。
(1)甲同学认为装置B中湿润的淀粉KI试纸变蓝即可证明无水FeCl3能分解产生Cl2,这个结论不够严密,因为该实验条件下能将I-氧化为I2的物质,除了无水FeCl3分解产生的Cl2外,还有装置中的氧气,以及沸点较低的FeCl3受热变成的FeCl3蒸气。
答案为:该实验条件下能将I-氧化为I2的物质,除了无水FeCl3分解产生的Cl2外,还有装置中的氧气,以及沸点较低的FeCl3受热变成的FeCl3蒸气。
(2)装置H中的试剂为NaOH溶液,吸收剩余的氯气。氯化铁沸点为315℃,加热到600℃会产生FeCl3蒸气,干扰试验,所以用装置F中饱和食盐水吸收FeCl3蒸气。,取装置D中残留固体溶于稀盐酸中,向所得溶液中加入KSCN溶液,若溶液未变红色说明溶液中不含Fe3+,FeCl3已经分解完全。
答案为:NaOH溶液;除去FeCl3蒸气;KSCN;溶液未变红色;
(3)装置F的溶液中含有FeCl3,FeCl3水解时溶液显酸性,水解的离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,加入镁条,镁可以和H+反应生成氢气,从而使水解平衡正向移动,促进Fe3+完全水解,生成Fe(OH)3沉淀。
Fe(OH)3+3H+,加入镁条,镁可以和H+反应生成氢气,从而使水解平衡正向移动,促进Fe3+完全水解,生成Fe(OH)3沉淀。
答案为:有气泡和红褐色沉淀产生;Fe3+水解:Fe3++3H2O![]() Fe(OH)3+3H+,Mg与H+反应,Mg+2H+=Mg2++H2↑产生氢气,pH升高,促进Fe3+完全水解,生成Fe(OH)3沉淀;
Fe(OH)3+3H+,Mg与H+反应,Mg+2H+=Mg2++H2↑产生氢气,pH升高,促进Fe3+完全水解,生成Fe(OH)3沉淀;


科目:高中化学 来源: 题型:
【题目】下列各项比较中,一定相等的是()
A.相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO-)
B.相同质量的钠分别完全转化为Na2O和Na2O2时转移的电子数
C.相同物质的量的丙烷和2-甲基丙烷中所含C-H键的数目
D.标准状况下,相同体积的乙炔和苯中所含的H原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
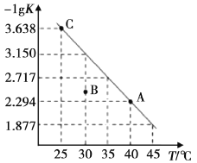
A.C点对应状态的平衡常数K(C)=10-3.638
B.该反应的ΔH>0
C.NH3的体积分数不变时,该反应一定达到平衡状态
D.30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.7g铝粉分别与体积均为100mL、浓度均为1.5mol/L的①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积(相同条件)是
A.①=②=③B.①=②>③C.①>②>③D.②>①=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g) ![]() 2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )

A. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小 为:c>b>a
B. 若T2>T1,则正反应一定是放热反应
C. 达到平衡时A2的转化率大小为:b>a>c
D. 若T2>T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的数值,下列说法正确的是
A.22.4 L 乙烷中所含的极性共价键数目为 7NA
B.某温度下,将 1molCl2 通入足量水中转移电子数为 NA
C.常温常压下,3.0 g 含葡萄糖的冰醋酸中含有的原子总数为 0.4NA
D.室温下,1LpH 为 13 的 NaOH 溶液和 Ba(OH)2 混合溶液中含 OH-个数为 0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸阿比朵尔,适合治疗由 A、B 型流感病毒引起的上呼吸道感染,2020 年入选新冠肺炎试用药物,其合成路线:
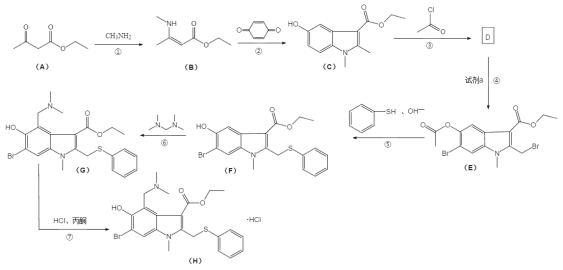
回答下列问题:
(1)有机物 A 中的官能团名称是______________和______________。
(2)反应③的化学方程式______________。
(3)反应④所需的试剂是______________。
(4)反应⑤和⑥的反应类型分别是______________、______________。
(5)I 是 B 的同分异构体,具有两性并能与碳酸氢钠溶液反应放出气体,写出具有六元 环结构的有机物 H 的结构简式______________。 (不考虑立体异构,只需写出 3 个)
(6)已知:两分子酯在碱的作用下失去一分子醇生成β—羟基酯的反应称为酯缩合反应,也称为 Claisen (克莱森)缩合反应,如: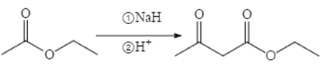 ,设计由乙醇和
,设计由乙醇和![]() 制备
制备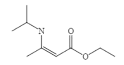 的合成线路______________。(无机试剂任选)
的合成线路______________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 乙烯和甲苯分子中所有原子都在同一个平面上
C. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D. ![]() 和CH3-CH=CH2互为同分异构体
和CH3-CH=CH2互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com