
| A、是否具有丁达尔效应 |
| B、是否能通过滤纸 |
| C、是否透明、均一、稳定 |
| D、分散质粒子直径的大小 |
科目:高中化学 来源: 题型:
| A、ABCDE |
| B、CDABE |
| C、BADCE |
| D、ECDBA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以42He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
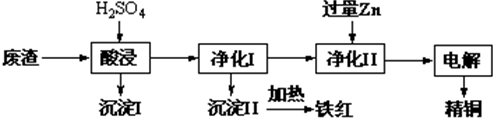
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| R | 在第3周期元素中,R的简单离子半径最小 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
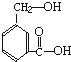 在某有机物A的分子中,具有醇羟基、羧基等官能团,其结构简式如图.
在某有机物A的分子中,具有醇羟基、羧基等官能团,其结构简式如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com