
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是( )
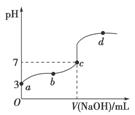
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中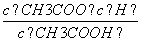 相等
相等
科目:高中化学 来源: 题型:
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g) + Y(g)  2Z(g),△H<0,下列叙述正确的是高 考 资 源 网( )
2Z(g),△H<0,下列叙述正确的是高 考 资 源 网( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率:v正(X) = 2v逆(Z)
C.达到平衡后,降低温度,正反应速率减小的倍数小于逆反应减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y是元素周期表ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表有______个横行,叫周期,每一周期中元素原子的_______________相同,从左到右元素的金属性_________(填增强或减弱);元素周期表中有________列,第ⅥA族处在第_________列,同一主族从上到下,元素的非金属性依次_________(填增强或减弱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g)  2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)=0.4 mol / (L·s) B.υ(C)=0.5 mol / (L·s)
C.υ(B)=0.6 mol / (L·s) D.υ(A)=0.15 mol / (L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合后,在交换膜处SO 从右向左移动。下列分析不正确的是
从右向左移动。下列分析不正确的是
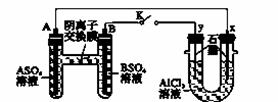
A.溶液中[A2+]增大 B.B的电极反应:B―→B2++2e-
C.y电极上有Cl2产生,发生氧化反应
D.反应初期x电极周围出现白色沉淀,随后沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
央视“315特别行动”曝光了河南一些地方“瘦肉精”事件。“瘦肉精”对人体健康会产生危害。已知某种“瘦肉精”含有克伦特罗(Clenbuterol),其结构如下图。下列有关克
伦特罗的叙述,正确的是
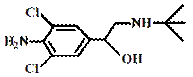 A.该物质的分子式为C12H17ON2Cl
A.该物质的分子式为C12H17ON2Cl
B.该物质不溶于盐酸
C.该物质能与FeCl3溶液发生显色反应
D.该物质分子间都可以形成氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
I.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol 。
。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
II.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:

(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH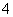 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH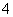 )。
)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO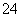 )-c(NH
)-c(NH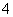 )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com