
| A. | 用分液的方法可以分离汽油和水 | |
| B. | 酒精灯加热试管时须垫石棉网 | |
| C. | NH3能使湿润的蓝色石蕊试纸变红 | |
| D. | 盛放NaOH溶液的广口瓶,可用玻璃塞 |
分析 A.用分液的方法分离互不相溶的液体混合物;
B.试管可以用酒精灯直接加热;
C.氨气溶于水显碱性,使石蕊变蓝色;
D.NaOH溶液能与玻璃塞磨砂部分反应生成硅酸钠.
解答 解:A.用分液的方法分离互不相溶的液体混合物,汽油与水互不相溶,用分液的方法可以分离汽油和水,故A正确;
B.试管可以用酒精灯直接加热,所以酒精灯加热试管时不用垫石棉网,故B错误;
C.氨气溶于水显碱性,使石蕊变蓝色,所以NH3能使湿润的红色石蕊试纸变蓝,故C错误;
D.NaOH溶液能与玻璃塞磨砂部分反应生成硅酸钠,硅酸钠具有黏性,能把瓶塞和瓶子黏在一起,不能打开,故D错误.
故选A.
点评 本题考查混合物的分离提纯和物质的检验方法,为高频考点,把握物质的性质及性质差异为解答的关键,侧重化学与生后的考查,有利于培养学生良好的科学素养,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将废弃的聚乙烯泡沫直接填埋 | B. | 焚烧废旧电脑器件回收金属 | ||
| C. | 生活垃圾直接作为饲料喂养家畜 | D. | 废弃农作物发酵制备沼气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br- | |
| B. | 水电离出的c(H+)=10-13mol•L-1的溶液中:Fe3+、K+、CO32-、SO32- | |
| C. | 室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中:Al3+、Na+、SiO32-、HCO3- | |
| D. | 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与过量的澄清石灰水反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 用食醋除去热水瓶水垢中CaCO3:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向氢氧化钡溶液中滴加足量稀硫酸:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 金属钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油干馏可得到汽油、煤油等 | |
| B. | 苯不能使酸性KmnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 淀粉、蛋白质完全水解的产物互为同分异构体 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃、l0IKPa下,NA个C18O2分子的质量为48g | |
| B. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| C. | 1mol白磷(P4)分子中所含化学键的数目为4NA | |
| D. | 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
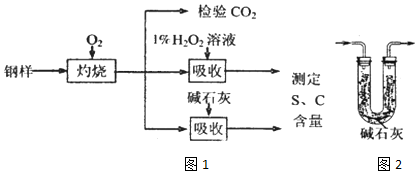
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
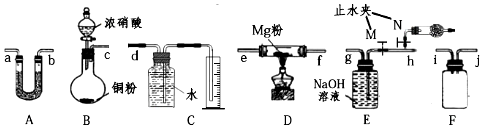
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com