
����Ŀ������Լռ����������71%����ˮ��ѧ��Դ�����þ��зdz�������ǰ����
��1����ˮɹ�οɻ�ô��Σ���ʵ�����д��ξ����ܽ⡢________��________���Ƶþ��Ρ��������������ƣ�
��2��þ����Ͻ���һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ģ�����Ҫ�������£�
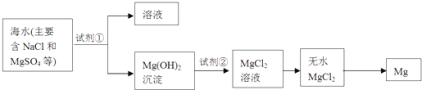
��Ϊ��ʹMgSO4ת��ΪMg��OH��2 �� �Լ��ٿ���ѡ��________��
���Դӽ�Լ��Դ����߽���þ�Ĵ��ȷ������������˵�ұþ������________��
A��Mg��OH��![]() MgO
MgO![]() Mg B��Mg��OH��
Mg B��Mg��OH��![]() MgO
MgO![]() Mg
Mg
C��Mg��OH��2![]() MgCl2
MgCl2![]() Mg D��Mg��OH��2
Mg D��Mg��OH��2![]() MgCl2
MgCl2![]() Mg
Mg
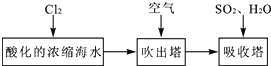
��3���弰�仯������;ʮ�ֹ㷺���ҹ����ڴ�����չ��ˮ������о��Ϳ�����������ҵ��Ũ����ˮΪԭ����ȡ��IJ��ֹ������£�
ij����С����ʵ����ģ�����������������װ�ý���ʵ�飨��������Ʒ���ѱ��������г�װ������ȥ����
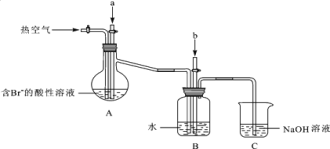
��Aװ����ͨ��a�����Ŀ���ǣ������ӷ���ʽ��ʾ��______________________________��
��Aװ����ͨ��a����һ��ʱ���ֹͣͨ�룬��ͨ�ȿ�����ͨ���ȿ�����Ŀ����___________��
�۷�Ӧ�����У�Bװ������SO42�����ɣ�����SO42���ķ�����____________________________��
��Cװ�õ�������______________________________________________��
���𰸡����� ���� NaOH����ʯ���飩 C Cl2+2Br��=2Cl��+Br2 ����Br2 ȡ����Bװ���з�Ӧ�����Һ���Թ��У��μ��Ȼ�����Һ��������ɫ������֤����SO42�� ����δ��Ӧ��Cl2��Br2��SO2
��������
��1�������ᴿ����Ҫ�����ǣ��ܽ⡢���ˡ�������
��2����ʹMgSO4ת��ΪMg��OH��2��Ӧѡ��
��MgO���۵�ߣ��Ʊ�þһ�����õ�����ڵ�MgCl2��
��3��������������ԭ��Ӧԭ����ȡ�嵥�ʣ�
�������¶��ܴٽ���ӷ���
���������ữ���Ȼ�����Һ��Ӧ����SO42-��
���塢�����Ͷ��������ж�������ֱ���ſա�
��1�������ᴿ����Ҫ�����ǣ��ܽ⡢���ˡ�������
��2����ʹMgSO4ת��ΪMg��OH��2��Ӧѡ�����Լ���ѡ��NaOH��ʯ���飻
��þ�ǻ��ý��������û�ԭ����ȡ��MgO���۵�ߣ��������õ����������þ�ķ���ұ��þ��Ӧ���õ�������Ȼ�þ�ķ���ұ��þ���������˵�ұþ������C����ѡC��
��3����Ҫ��ʹ�����ӱ���嵥�ʣ�������a�ܺ������ӷ�����Ӧ�����嵥�ʣ������ܺ������ӷ����û���Ӧ�����嵥�ʣ����ӷ�Ӧ����ʽΪ��Cl2+2Br-=2Cl-+Br2��
�����ӷ��������¶ȴٽ���ӷ�������ͨ���ȿ�����Ŀ���Ǵ���Br2��
������ǿ�����ԣ��ܺͶ���������������ԭ��Ӧ�����������Ӻ���������ӣ���������Ӻ������ữ���Ȼ�����Һ��Ӧ���������Եİ�ɫ���ᱵ������������������ӵļ��鷽��Ϊ��ȡ����Bװ���з�Ӧ�����Һ���Թ��У��μ��Ȼ�����Һ��������ɫ������֤����SO42-��
��������������ȫ��Ӧ�������������ӷ�Ӧ�����嵥�ʣ�δ��Ӧ�Ķ��������������嶼�ж�������ֱ���ſգ����⼸�����ʶ��ܺͼӦ������Cװ����β������װ�ã�����C�������ǣ�����δ��Ӧ��Cl2��Br2��SO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2SO2(g)��O2(g)![]() 2SO3(g)�������仯��ͼ��ʾ,����˵������ȷ����( )
2SO3(g)�������仯��ͼ��ʾ,����˵������ȷ����( )
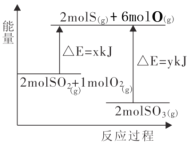
A.������ӦΪ���ȷ�Ӧ
B.�÷�Ӧ������������������������
C.���ȷ�Ӧһ��Ҫ���Ⱥ���ܷ���
D.2molS(g)��6molO(g) ����2molSO3(g)�����ų�y kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:2CH3COCH3(1)![]() CH3COCH2COH(CH3)2(1)��ȡ����CH3COCH�ֱ���0����20���·�Ӧ,�����ת����(��)��ʱ��(t)�仯�Ĺ�ϵ��������ͼ��ʾ������˵����ȷ����
CH3COCH2COH(CH3)2(1)��ȡ����CH3COCH�ֱ���0����20���·�Ӧ,�����ת����(��)��ʱ��(t)�仯�Ĺ�ϵ��������ͼ��ʾ������˵����ȷ����
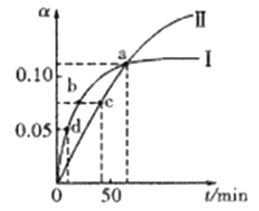
A. ��������ʾ20��ʱ��ת����Ӧ
B. �����¶�����߷�Ӧ���ƽ��ת����
C. ��a��ʱ,������������ʾ��Ӧ�Ļ�ѧƽ�ⳣ�����
D. ��ѧ��Ӧ���ʵĴ�С˳��Ϊ:d>b>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ���Ϊ��������Դ�Ȼ�ʯ��Դ���нϴ�����ƣ���ͼΪ�Ҵ�ȼ�ϵ�أ��õ�ص��ܷ�Ӧ����ʽΪC2H5OH+3O2=2CO2+3H2O�����й��ڸõ�������������

A.a�����õ������������B.��װ�ý���ѧ��ת��Ϊ����
C.����(H+)��װ��������Ҳ��ƶ�D.��װ�õĵ������Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ�ɻ��������Դ������(![]() )������˵������ȷ����
)������˵������ȷ����
��![]()
![]()
��![]()
![]()
��![]()
![]()
��![]()
![]()
A. ��Ӧ�١���Ϊ��Ӧ���ṩԭ����
B. ��Ӧ��Ҳ��![]() ��Դ�����õķ���֮һ
��Դ�����õķ���֮һ
C. ��Ӧ![]() ��
��![]()
D. ��Ӧ![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ʊ����������ĺϳ�·��֮һ����ͼ��ʾ��
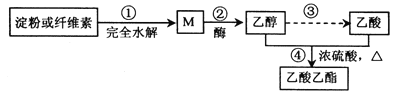
����˵����ȷ���ǣ� ��
A. ���ۺ���ά�ػ�Ϊͬ���칹��
B. ��Ӧ��:1 mol M �ھƻ�ø�����¿�����3 molCH3CH2OH
C. ��Ӧ��:�Ҵ����������跴Ӧ������Ϊ�����ظ������Һ
D. ��Ӧ��������ͨ����з�̪�ı���̼������Һ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���屽���۵�Ϊ30.8�棬�е�156�档ʵ�����ñ���Һ����ȡ�屽��װ����ͼ��
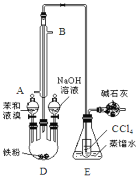
��1�������ܵ�����___��
��2��E��С�Թ���CCl4����___��
��3����ʵ��֤����ȡ�屽�ķ�Ӧ��ȡ����Ӧ�������ӵ��Լ���___��
��4��д��ͼ��װ�м�ʯ�ҵ�����������___��
��5�������廹���ܷ�������Ӧ���ɶԶ��屽���е�220�棩���ڶ��屽���е�224�棩����ʵ��õ����屽�л����ж��屽����ͨ��___������뷽�����ᴿ�õ��屽��д�����ɶԶ��屽�Ļ�ѧ����ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ��֣�H2S�Ǽ�NO��CO֮��ĵ�����������ϵ�����źŷ��ӣ������в���������źŴ��ݡ�����Ѫ�ܼ����Ѫѹ�Ĺ��ܡ��ش��������⣺
��1����ͼ��ͨ���Ȼ�ѧѭ���ڽϵ��¶�����ˮ������ֽ��Ʊ������ķ�Ӧϵͳԭ����

ͨ�����㣬��֪ϵͳ����ϵͳ����������Ȼ�ѧ����ʽ�ֱ�Ϊ__��__���Ƶõ���H2�����������ٵ���__��
��2��H2S��CO2�ڸ����·�����Ӧ��H2S(g)+CO2(g)![]() COS(g)+H2O(g)����610Kʱ����0.10molCO2��0.40molH2S����2.5L�Ŀո�ƿ�У���Ӧƽ���ˮ�����ʵ�������Ϊ0.02��
COS(g)+H2O(g)����610Kʱ����0.10molCO2��0.40molH2S����2.5L�Ŀո�ƿ�У���Ӧƽ���ˮ�����ʵ�������Ϊ0.02��
��H2S��ƽ��ת������1=__%����Ӧƽ�ⳣ��K=__��
����620K�ظ����飬ƽ���ˮ�����ʵ�������Ϊ0.03��H2S��ת������2__��1���÷�Ӧ����H__0��������>����<������=����
����Ӧ�����ٷֱ�����������壬��ʹH2Sת�����������__�����ţ�
A.H2S B.CO2 C.COS D.N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ӣ����������Ϊ��������������ij��ѧ��ȤС�����������ʵ��̽����ǿ����
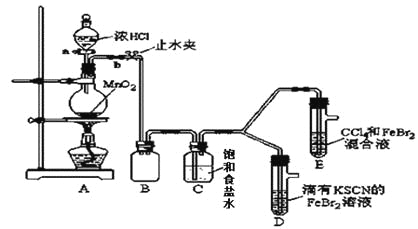
��1����װ��A�з�����Ӧ�����ӷ���ʽ��_________________��
������ʵ��װ�ô���һ�����ԵIJ��㣬��ָ��________��
��2���ø������װ�ý���ʵ�飬ʵ��������£�
ʵ����� | ʵ������ | ���� |
����a����Բ����ƿ�е�������Ũ���Ȼ��_______________���������ʵ������� | Dװ���У���Һ��� Eװ���У�ˮ����Һ��ƣ� ���²�CCl4�������Ա仯��һ��ʱ���______������ʵ������ | Cl2��Br2��Fe3+����������ǿ������˳��Ϊ��Cl2��Br2��Fe3+ |
��3����æ�ڹ۲�ͼ�¼��û�м�ʱֹͣ��Ӧ��D��E�о��������µı仯��
Dװ���У���ɫ������ȥ��
Eװ���У�CCl4����ɫ���ֱ����ɺ�ɫ��
Ϊ̽������ʵ������ı��ʣ�С��ͬѧ����������£�
����Fe3+ +3SCN-![]() Fe(SCN)3��һ�����淴Ӧ��
Fe(SCN)3��һ�����淴Ӧ��
����(SCN)2������±�ص������ơ������ԣ�Cl2 �� (SCN)2��
������ƽ���ƶ�ԭ��������������ϣ�����Cl2����ʱD����Һ��ɫ��ȥ��ԭ��____������Ƽ�ʵ��֤���������ͣ�ȡ������ɫ�����Һ���μ�________��Һ������Һ��ɫ______________�������������Ǻ����ġ�
С��ͬѧ������������£�
����Cl2��Br2��Ӧ����BrCl��BrCl�ʺ�ɫ���Դ���ɫ�����е�Լ5��������ˮ�ܷ���ˮ�ⷴӦ���Ҹ÷�ӦΪ��������ԭ��Ӧ��
����AgClO��AgBrO��������ˮ��
����̽��E����ɫ�仯��ԭ�����ʵ�����£�
�÷�Һ©�������E���²���Һ�������ռ���ɫ���ʣ�ȡ����������AgNO3��Һ������۲쵽���а�ɫ�������������������������������ӷ���ʽ���ͽ�������ɫ����ԭ��___________��___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com