
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
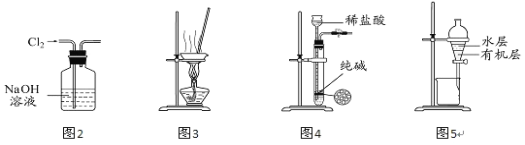
A.用图2所示装置除去Cl2中含有的少量HCl
B.用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图4 所示装置制取少量纯净的CO2气体
D.用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____X=___
(2)A在5min末的浓度是___
(3)此时容器内的压强与开始时之比为:____。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。写出它的电子式______;
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___。Se2Cl2常用作分析试剂,其结构式为___。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积固定的密闭容器中,发生可逆反应A(g)+2B(g)![]() 2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是( )
2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是( )
A.刚充人时反应速率:v(正)减小,v(逆)增大
B.达到新的平衡时:反应混合物中A.B的物质的量分数不变
C.达到新的平衡时:c(A):c(B):c(C)仍为1:1:2
D.达到新的平衡过程中:体系压强先增大,后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g) ![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
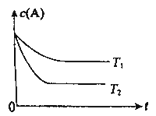
(1)上述反应的温度T1____ T2,平衡常数K(T1)____K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为________。
②反应的平衡常数K=_______。
③反应在0~5min区间的平均反应速率v(A)=________。
(3)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______。
(4)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 ![]() 2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS_____0(填“>”、“<”或“=”)。在______填“较高”或“较低”)温度下有利于该反应自发进行。
2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS_____0(填“>”、“<”或“=”)。在______填“较高”或“较低”)温度下有利于该反应自发进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:

(1)若X是强氧化性单质,则A不可能是____。
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为____。
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____;C溶液在贮存时应加入少量X,理由是(离子方程式表示)___,检验此C溶液中金属元素价态的操作方法是____。
(4)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为____,X的化学式可能为(写出不同类物质)____或____,反应②的离子方程式为___或___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.碘酸钾(KIO3)是一种白色或无色固体,可溶于水,具有较强的氧化性。常添加于食盐中用以防治碘缺乏病。已知在某反应体系中存在以下几个物质: KIO3、K2SO4、KI、I2、H2SO4、H2O。
(1)书写并配平该反应方程式,并标出电子转移的方向和数目:_________________;
(2)下列说法中正确的是_________。
A.I2是非电解质 B.K2SO4溶液的导电能力一定比KI溶液的强
C.H2SO4没有参加氧化还原反应 D.氧化产物和还原产物都是I2
Ⅱ.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用,实验室可用KClO3通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
试回答下列问题。
(3)该反应中还原产物的化学式是_________;被氧化的元素是_________。
(4)生成标况下4.48LCO2,电子转移数是_______________。
(5)ClO2和Cl2均能将电镀废水中的CN 反应为无毒的物质,自身反应后均生成Cl,此过程说明ClO2和Cl2均具有_________ (填“氧化”或“还原”)性。处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的_________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。

(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com