
| A、X、Y、Z均属于短周期元素 |
| B、离子半径X+>Y- |
| C、Y的气态氢化物可形成氢键 |
| D、X、Y、Z三种元素组成的化合物中既含有离子键又含有共价键 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、由水电离出来的H+的浓度是1.0×10-12mol?L-1 |
| B、该温度高于25℃ |
| C、NaHSO4晶体的加入抑制了水的电离 |
| D、该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Fe2O3+3CO
| ||||
| B、CO2+H2O=H2CO3 | ||||
C、CuO+H2
| ||||
D、2Na+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2的摩尔质量为44g |
| B、标准状况下,2.24L CCl4所含的原子数为0.5NA |
| C、5.4mL4℃的H2O中有1.806×1023个分子 |
| D、50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物质的量之和是0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质发生化学反应都伴随着能量变化 |
| B、伴有能量变化的物质变化都是化学变化 |
| C、在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
| D、凡是经过加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V1<V2 |
| B、V1=3V2 |
| C、V1>V2 |
| D、以上三种情况都有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
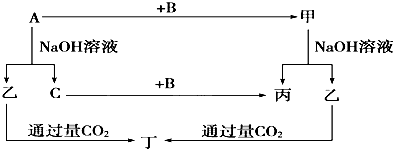
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com