
【题目】为了减少 CO 对大气的污染,某研究性学习小组拟研究 CO 和 H2O 反应转化为绿色能源H2。已知:
2CO(g)+O2(g) =2CO2(g); H=-566kJ·moL-1
2H2(g)+O2(g) =2H2O(g); H=-483.6kJ·moL-1
H2O(g) =H2O(l); H=-44.0kJ·moL-1
(1)表示氢气燃烧热的化学方程式中 △H=__________。
(2)写出CO和 H2O(g)作用生成 CO2 和 H2 的热化学方程式____________________________________________。
(3)往 1L 体积不变的容器中加入 0.200mol CO 和 1.00mol H2O(g),在 t℃时反应并达到平衡,若该反应的化学平衡常数 K=1(方程式中各物质前化学计量数为最简比),则 t℃时 CO 的转化率为____;反应达到平衡后,升高温度,此时平衡常数将__________ (填“变大”、 “不变”或“变小”),平衡将向__________ (填“正”或“逆”)方向移动。
【答案】-285.8 CO(g)+H2O(g)=H2(g)+CO2(g) △H=-41.2KJmoL-1 50% 变小
【解析】
(1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热,利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减,据此书写判断;
(2)利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
(3)令参加反应的CO的物质的量为nmol,利用三段式用n表示出平衡时各组分的物质的量,用物质的量代替浓度代入平衡常数计算n的值,再利用转化率定义计算;升高温度平衡向吸热反应移动,结合(2)中的热化学方程式判断,升高温度平衡移动方向,据此进行判断温度对平衡常数的影响。
(1) 已知:①2H2(g)+O2(g) =2H2O(g) △H=-483.6KJmoL-1;②H2O(g) =H2O(l) △H=-44.0KJ moL-1,根据盖斯定律,①×![]() +②得H2(g)+
+②得H2(g)+![]() O2(g) =H2O(l) △H=
O2(g) =H2O(l) △H=![]() ×(-483.6KJmoL-1)+(-44.0KJmoL-1)=-285.8KJmoL-1;故答案为:-285.8;
×(-483.6KJmoL-1)+(-44.0KJmoL-1)=-285.8KJmoL-1;故答案为:-285.8;
(2)已知:①2CO(g)+O2(g) =2CO2(g) △H=-566kJmoL-1;②2H2(g)+O2(g) =2H2O(g) △H=-483.6KJmoL-1,根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g) △H=-566kJmoL-1-(-483.6KJmoL-1)=-82.4KJmoL-1,即CO(g)+H2O(g)=H2(g)+CO2(g) △H=-41.2KJmoL-1,故答案为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=-41.2KJmoL-1;
(3) 令参加反应的CO的物质的量为nmol,则:
CO(g)+H2O(g)=H2(g)+CO2(g)
开始(mol):0.200 1.00 0 0
变化(mol):n n n n
平衡(mol):0.200-n 1.00-n n n
所以![]() =1,解得n=
=1,解得n=![]() ,故t℃时CO的转化率为
,故t℃时CO的转化率为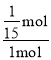 ×100%=6.67%;由(2)可知该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数变小,故答案为:50%;变小;逆;
×100%=6.67%;由(2)可知该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数变小,故答案为:50%;变小;逆;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n (H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)=____________mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=____________mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为__________反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正)______v(逆)(填“>”、“<”或“=”)。
(5)若该容器体积不变,能判断反应达到平衡的是_______________。
①c(CO)与c(H2)的比值保持不变;②v(CO2)正=v(H2O)逆;③体系的压强不再发生变化;④混合气体的密度不变;⑤体系的温度不再发生变化;⑥气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将![]() 通入适量NaOH溶液中,产物中可能含有NaCl、NaClO、
通入适量NaOH溶液中,产物中可能含有NaCl、NaClO、![]() ,且
,且 的值与温度高低有关。当
的值与温度高低有关。当![]() mol时,下列说法不正确的是( )
mol时,下列说法不正确的是( )
A.参加反应的氯气的物质的量等于![]()
B.改变温度,产物中![]() 的最大理论产量为
的最大理论产量为![]()
C.改变温度,反应中转移电子的物质的量![]() 的范围为
的范围为![]()
D.若某温度下,反应后 ,则溶液中
,则溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗常数的值。下列叙述正确的是( )
代表阿伏加德罗常数的值。下列叙述正确的是( )
A.将![]() 通过
通过![]() 使其增重
使其增重![]() 时,反应中转移电子数为
时,反应中转移电子数为![]()
B.将![]() 通入到水中,则
通入到水中,则![]()
C.常温常压下,![]() 含甲醛
含甲醛![]() 的冰醋酸中含有的原子总数为
的冰醋酸中含有的原子总数为![]()
D.![]() 的
的![]() 中含有的
中含有的![]() 键数为
键数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有HCHO、H2、O2共26.5 g,用电火花引燃烧,使其充全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重10.5 g,则原混合气体中O2的物质的量是
A.0.5molB.0.25molC.0.27 molD.0.52 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,满足下列条件的溶液一定呈碱性的是( )
A.c(H+)<c(OH-)B.pH=7.2
C.能与金属Al反应放出H2D.能使广泛pH试纸呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1 mol·L-1氨水的叙述正确的是
A.加入少量氯化钠溶液,平衡不移动
B.加入少量NaOH固体,平衡正向移动
C.通入少量氯化氢气体,平衡正向移动
D.加入少量MgSO4固体,抑制NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对化学反应描述的观点中正确的有几项:①放热反应在常温下均能自发进行;②电解过程中,化学能转化为电能而“储存”起来;③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;⑤盐类均能发生水解反应;⑥相同温度下,同一反应的化学平衡常数的大小与化学反应方程式的书写有关( )
A.1项B.2项C.3项D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验必须注意安全.下列做法不正确的是( )
A.不慎将浓碱沾到皮肤上,立即用大量水冲洗,再涂上![]() 的硼酸溶液
的硼酸溶液
B.在点燃或加热可燃气体前检验其纯度,防止发生爆炸
C.向正在燃烧的酒精灯里添加酒精
D.钠燃烧着火,应用干燥的沙土盖灭
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com