
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。

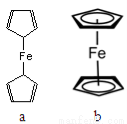
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式 。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。
(1)铁元素的相对原子量(或铁元素的原子量)(1分) 26种(1分)
(2)分子晶体(1分) b(1分)
(3)12Fe2+ + 6H2O + 3O2 → 8 Fe3+ + 4Fe(OH)3(2分)
(4)铁和氯气(2分)
(5)10mol(2分)
(6)2 L (2分)
【解析】
试题分析:(1)55.85表示铁元素的相对原子量(或铁元素的原子量);铁元素核外电子数是26,所以铁原子核外有26种运动状态不同的电子。
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂,这说明二茂铁属于分子晶体;由于二茂铁中所有氢原子的化学环境都相同,这说明分子的结构对称,因此二茂铁的结构应为右图中的b。
(3)亚铁离子具有还原性易被氧化,所以发生变质反应的离子方程式为12Fe2+ + 6H2O + 3O2 → 8 Fe3+ + 4Fe(OH)3。
(4)FeCl3遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O),因此一般不通过复分解反应制备氯化铁,所以制备无水FeCl3的试剂是铁和氯气。
(5)根据反应式可知,反应中铁元素的化合价从+2价升高到+6计算,失去4个电子。另外过氧化钠中氧元素的化合价从-1价升高到0价,失去1个电子,则生成1mol氧气转移2mol电子,所以若生成2mol Na2FeO4,则反应中电子转移的物质的量为2mol×4+2mol=10mol。
(6)反应中锰元素的化合价从+2价升高到+4价,失去2个电子。而铁元素的化合价从+6价降低到+3价,所以根据电子得失守恒可知,若氧化含 Mn2+ 1mg的水体样本,设需要1.2 mg/L高铁酸钾溶液的体积为V,则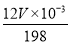 ×3=
×3=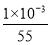 ×2,解得V=2L。
×2,解得V=2L。
考点:考查核外电子排布、晶体类型判断、氧化还原反应的应用以及计算


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
铜锌原电池装置(见图),下列分析正确的是
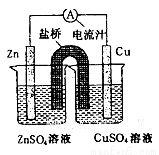
A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B.原电池工作时,Cu电极流出电子,发生氧化反应
C.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)写出该可逆反应的化学平衡常数表达式 ;
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是 (填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | t |
(3)实验1从开始到反应达到化学平衡时,υ(SO2)表示的反应速率为 ;
T1 T2 (选填“>”、“<”或“=”),理由是 。尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与 c(OH-) 之比为 。
该溶液中c(OH—) = c(H+)+ + (用溶液中所含微粒的浓度表示)。
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 (用编号排序)
A.Na2SO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
针对下图装置的说法中,正确是
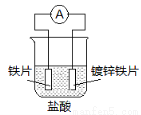
A.溶液中pH值明显下降
B.铁片为正极,镀锌铁片为负极
C.阴极的电极反应式:Fe-2e→Fe2+
D.电子由锌经溶液流向铁
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:填空题
将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2 L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)= 。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤: 。c(NaOH)= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
如图是工业制纯碱的部分物质转化示意图,下列推测错误的是
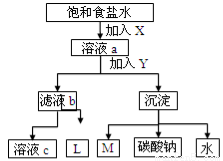
A.若是联碱法,溶液c可在转化流程中循环利用
B.若是氨碱法,则L的主要成分是NaCl
C.M可在转化流程中循环利用
D.X是NH3 ,Y是CO2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中物质 | b中物质 | c中收集气体 | d中物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | 浓盐酸 | HCl | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:填空题
(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 |
|
|
| ① | ② |
| ③ |
|
三 |
| ④ | ⑤ | ⑥ |
|
| ⑦ | ⑧ |
四 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)在这些元素中,⑩原子的原子结构示意图为 。
(2)写出①的最高价氧化物和②的单质的电子式 , 。
(3)用电子式表示③与④形成化合物的过程 。
(4)①的单质和⑥的氧化物反应的化学方程式 。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出 kJ的热量。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:选择题
下列图示实验现象及其解释不正确的是( )
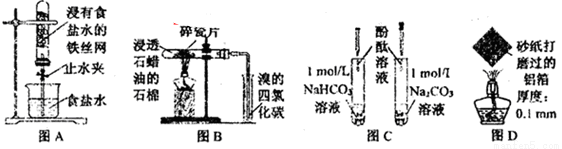
A.图A,一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀
B.图B,加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生
C.图C,溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32-
D.图D,加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com