
【题目】铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中,铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。工业流程如下:
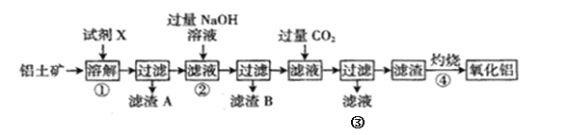
(1)试剂X应选择______(填标号)。
A.过量NaOH溶液 B.过量稀盐酸 C.过量FeCl3溶液
(2)若在实验室进行过滤操作,必须用到的玻璃仪器除了烧杯,还有_________;
(3)滤渣A和B的主要成份分别为_____、______;
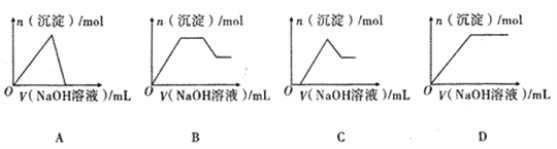
(4)若②中逐滴滴加NaOH溶液,则实验过程中产生沉淀的物质的量与加入NaOH溶液的体积之间的关系图正确的是_______;(填标号)
(5)③中与NaOH溶液反应的离子方程式为__________;
(6)④中发生反应的化学方程式为______________。
【答案】B 漏斗和玻璃棒 二氧化硅 氢氧化铁 C HCO3-+OH-=CO32-+H2O 2Al(OH)3![]() Al2O3+H2O
Al2O3+H2O
【解析】
铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,步骤①用盐酸溶解,发生反应:Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O,过滤得到滤渣A中含有SiO2,滤液中含Fe3+、Al3+,向该滤液中加入过量的NaOH溶液,Al3+反应生成NaAlO2溶液,Fe3+形成Fe(OH)3沉淀,过滤,Fe(OH)3进入滤渣B中,向滤液中再通入过量的二氧化碳气体,NaAlO2发生反应生成Al(OH)3的沉淀,将Al(OH)3灼烧生成Al2O3,最后电解熔融的Al2O3得到铝单质,以此解答该题。
由以上分析可知:
(1)试剂X是稀盐酸,故合理选项是B;
(2)若在实验室进行过滤操作,必须用到的玻璃仪器除了烧杯,还有漏斗、玻璃棒;
(3)根据上述分析可知滤渣A主要成分是SiO2;滤渣B的主要成分是Fe(OH)3;
(4)在②是溶液在含有过量HCl、AlCl3、FeCl3,向其中逐滴加入过量的氢氧化钠溶液,首先发生酸碱中和反应:H++OH-=H2O,开始滴加无沉淀产生,后发生反应:Al3++3OH-=Al(OH)3↓;Fe3++3OH-=Fe(OH)3↓;当Al3+、Fe3+恰好反应完全时,沉淀达到最大值,后再加入NaOH溶液,发生反应:Al(OH)3+OH-=AlO2-+2H2O,由于Fe(OH)3不能被NaOH溶液溶解,当Al(OH)3恰好反应完全后,沉淀的量不再发生变化,故合理的图象是C;
(5)向NaAlO2溶液中通入过量CO2气体,发生AlO2-+CO2+H2O=Al(OH)3↓+HCO3-,过滤得到滤渣中含有Al(OH)3,得到的滤液③中含有HCO3-,向该溶液中加入NaOH溶液,发生反应: HCO3-+OH-=CO32-+H2O;
(6)滤渣是Al(OH)3,将其灼烧,发生分解反应:2Al(OH)3![]() Al2O3+H2O,最后得到氧化铝。
Al2O3+H2O,最后得到氧化铝。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】用碳化铝制取甲烷的化学方程式为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑。下列有关化学用语表示正确的是( )
A.铝离子的电子排布式:1s22s22p63s23p1
B.水分子的结构式:H—O—H
C.甲烷的比例模型:![]()
D.氢氧化铝的电离方程式:H++AlO2-+H2O=Al(OH)3=Al3++3OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式表达正确的是( )
A.向FeBr2 溶液中通入过量Cl2:2Fe2++Cl2 =2Fe3++2Cl-
B.向碳酸钠溶液中通入少量CO2:![]() +CO2+H2O=2
+CO2+H2O=2![]()
C.向碘化钾溶液中加入少量硫酸酸化的H2O2溶液:3H2O2 +I-=![]() +3H2O
+3H2O
D.Fe(OH)3 固体溶于 HI 溶液:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
![]()
A. 灼烧过程中使用的玻璃仪器有酒精灯、烧杯、玻璃棒
B. 氧化过程中发生反应的离子方程式为 2I-+H2O2 =I2+2OH-
C. 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明海带中含有碘单质
D. 分液时,先打开活塞放出下层液体,再关闭活塞从上口倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐的装置示意图如图1所示; 研究人员发现的一种“水”电池,其总反应为:5MnO2 +2Ag+2NaCl=Na2Mn5Ol0+2AgCl,用该“水”电池为电源电解NaCl溶液的实验装置如图2所示,电解过程中X电极上有无色气体逸出。下列说法正确的是( )
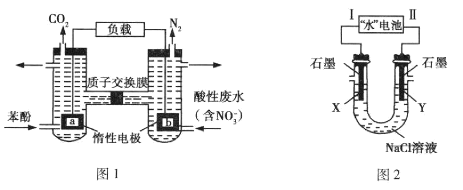
A.图1装置中若右池产生0.672 L气体(标准状况下),则电路中通过电子0.15 mol
B.图1装置中左池消耗的苯酚与右池消耗的![]() 的物质的量之比为28:5
的物质的量之比为28:5
C.图2装置的电路中每通过1 mol e-,U形管中消耗0.5 mol H2O
D.图2装置中“水”电池内每生成1 mol Na2Mn5O10,X电极上生成1 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol 某烃 A 在氧气中完全燃烧后,生成CO2和H2O各1.2mol 。试回答:
(1)烃A的分子式为______________。
(2)若取一定量的该烃 A完全燃烧后,生成CO2和H2O各3mol ,则有______ g 烃 A参加了反应,燃烧时消耗标准状况下的氧气______ L 。
(3)若烃 A 不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃 A 的结构简式为______。
(4)若烃 A 能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有 4个甲基,烃A可能有的结构简式为(写一种即可)______________。
(5)比烃 A 少一个碳原子且能使溴水褪色的 A 的同系物有______种同分异构体(包括顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3 与NaHCO3的性质判断正确的是![]()
![]()
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度盐酸反应的剧烈程度:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2Cr2O4。考虑到胶体的吸附作用使Na2Cr2O4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图1),使浆液分离成固体混合物和含铬元素溶液,并回收利用。

固体混合物的分离和利用的流程图如图2所示(流程图中的部分分离操作和反应条件未标明):

(1)反应①所加试剂NaOH的电子式为___,B→C的反应条件为___,C→Al的制备方法称为___。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有___(填序号)。
a.温度 b.Cl-的浓度 c.溶液的酸度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com