
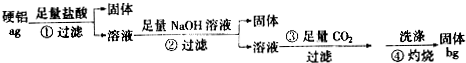
分析 由测定该合金中铝的含量流程可知,①加盐酸,Cu、Si不反应,则过滤得到的固体为Cu、Si,溶液中含Al3+、Mg2+,②加足量的NaOH,过滤得到的沉淀为Mg(OH)2,溶液中主要含AlO2-,③通足量的二氧化碳,反应生成Al(OH)3,④灼烧氢氧化铝分解得到Al2O3,
(1)先根据流程图分析实验的原理,然后写出对应的化学方程式;
(2)根据铝守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,最后求出铝的质量分数;
(3)第②步中加入NaOH的量不足的时,铝不能完全转变成AlO2-;对沉淀的灼烧不充分,会有水分,会增加灼烧后固体的质量.
解答 解:(1)第①步发生的化学方程式有两个:镁与盐酸反应,铝和盐酸反应,Mg+2H+═Mg2++H2↑,2Al+6H+═2Al3++3H2↑,
第②步发生的化学方程式有三个:盐酸和氢氧化钠反应,反应的离子方程式H++OH-=H2O,氯化铝和过量氢氧化钠反应,反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,氯化镁和氢氧化钠反应,反应的离子方程式为:Mg2++2OH-═Mg(OH)2↓,
第③步发生的化学方程式有两个:氢氧化钠和过量的二氧化碳反应,偏铝酸钠和过量的二氧化碳反应,离子反应为OH-+CO2=HCO3-,CO2+H20+A102-═Al(OH)3↓+HCO3-,
故答案为:2Al+6H+═2Al3++3H2↑;H++OH-=H2O;Al3++4OH-═AlO2-+2H2O;OH-+CO2=HCO3-;CO2+AlO2-+H2O═Al(OH)3↓+HCO3-;
(2)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为bg×$\frac{27×2}{27×2+16×3}$×100%=$\frac{54b}{102}$g,样品质量为ag,所以铝的质量分数=$\frac{\frac{54b}{102}}{a}$×100%=$\frac{54b}{102a}$×100%,
故答案为:$\frac{54b}{102a}$×100%;
(3)因NaOH的量不足,铝不能完全转变成AlO2-,最终产生的氧化铝质量少,造成结果偏低,因对沉淀的灼烧不充分时有水分,则灼烧后固体的质量变大,会使测定的结果偏高,
故答案为:偏低;偏高.
点评 本题考查了铝及其化合物化学性质的应用,要测定其中某成分的含量,可以使其发生化学反应,本题利用了守恒法来进行计算,能很好的考查学生的实验能力、分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: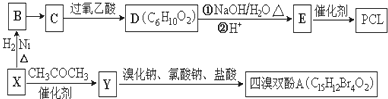
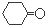

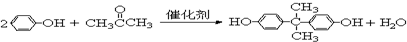 .
.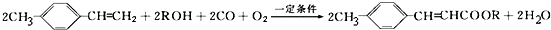
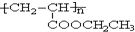 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: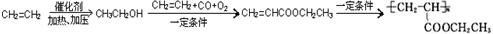 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个周期、18个族 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 工业上常用电解NaCl水溶液的方法制取金属钠 | |
| D. | 淀粉和纤维素互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com