
| A. | N2、H2不再化合 | |
| B. | N2、H2、NH3的质量相等 | |
| C. | N2、H2、NH3浓度不再变化 | |
| D. | 改变条件,N2、H2、NH3的浓度也不再变化 |
分析 根据化学平衡状态是反应达最大限度的状态,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,化学平衡是动态平衡,由此分析解答.
解答 解:A、化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故A错误;
B、化学平衡时,N2、H2、NH3的质量可能相等,也可能不等,与各物质的初始浓度及转化率有关,故B错误;
C、N2、H2、NH3浓度不再变化,说明各物质的量不变,反应达平衡状态,故C正确;
D、改变条件,平衡发生移动,N2、H2、NH3的浓度会发生变化,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 蚕丝、棉花的主要成分都是蛋白质 | |
| B. | 纤维素、油脂、蛋白质都能水解 | |
| C. | 误食重金属盐,可立即喝牛奶或蛋清解毒 | |
| D. | 乙醇可以与钠反应放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、淀粉、麦芽糖和蛋白质在一定条件都能发生水解反应 | |
| B. | 甲烷和苯都不能与溴水、酸性高锰酸钾溶液发生反应,但苯不属于饱和烃 | |
| C. | 将红热的铜丝迅速插入乙醇中,可观察到铜丝表面变红 | |
| D. | 苯、甲苯、二甲苯等有机物可通过煤的液化、气化后分离获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| C. | 医药中常用95%酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 | |
| D. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
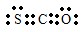 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
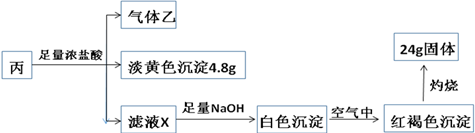
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
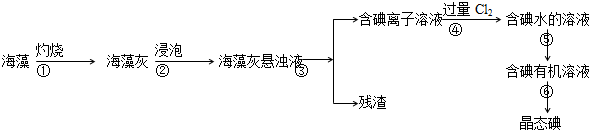
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2和CH2═CH2的最简式相同 | |
| B. | 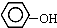 与 与 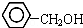 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
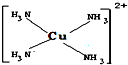 请回答下列问题:
请回答下列问题: (4)请写出HClO的电子式:
(4)请写出HClO的电子式: .
.| 电离能/KJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com