
分析 结合c=$\frac{n}{V}$及不当操作对n、V的影响分析误差,若n偏大或V偏小则浓度偏大,若n偏小或V偏大,则浓度偏小,以此来解答.
解答 解:(1)称好后的药品放入烧杯时,有少量洒在烧杯外,n偏小,由c=$\frac{n}{V}$可知,浓度偏小,故答案为:偏小;
(2)未洗涤烧杯和玻璃棒2次~3次,n偏小,由c=$\frac{n}{V}$可知,浓度偏小,故答案为:偏小;
(3)在定容时加水超过刻度线,再用胶头滴管吸出多余部分,V偏大,由c=$\frac{n}{V}$可知,浓度偏小,故答案为:偏小;
(4)洗涤容量瓶后,未干燥,瓶中有少量蒸馏水,n、V均无影响,则浓度无影响,故答案为:无影响.
点评 本题考查配制一定浓度的溶液,为高频考点,把握配制溶液的操作、浓度公式为解答的关键,侧重分析与应用能力的考查,注意结合公式分析误差,题目难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ?263 | B. | +263 | C. | ?352.1 | D. | +131.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
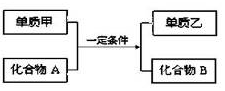
 ,在这个反应中作氧化剂的是H2O(填化学式)
,在这个反应中作氧化剂的是H2O(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

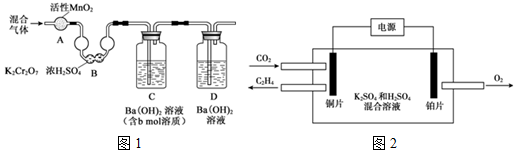
| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 通入氯化氢气体 | ||
| C. | 加入适量的氢氧化钠溶液 | D. | 加入固体AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL | B. | 5 mL | C. | 大于5 mL | D. | 小于5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用前要先检查容量瓶是否漏液 | |
| B. | 用蒸馏水洗涤后必须要将容量瓶烘干 | |
| C. | 为了方便快捷,可以直接在容量瓶内进行固体溶解 | |
| D. | 定容结束后,为了使溶液均匀,手握瓶颈,左右振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不再变化 | B. | X、Y、Z的物质的量之比为2:1:1 | ||
| C. | 混合气体的密度不再变化 | D. | X的分解速率是Y的分解速率的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com