
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.增大N2浓度可以使H2转化率达到100%
D.增大N2浓度可以增大反应速率
科目:高中化学 来源:2014-2015学年陕西西北大学附中高二下期末化学试卷(解析版) 题型:选择题
下列描述中不正确的是( )
A.CS2为V形的极性分子
B.ClO3-的空间构型为三角锥形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO32-的中心原子均为sp 3杂化
3杂化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期末化学试卷(解析版) 题型:推断题
有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。[

已知: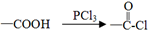
请回答以下问题:
(1)A的电子式是___________________________ _____;
_____;
(2)C→D的反应类型是________________________________;
(3)在一定条件下,两个E分子发生分子间脱水生成一种环状酯,写出该环状酯的结构简式__________;
(4)G与足量的氢氧化钠溶液反应的化学方程式是________________________________;
(5)满足以下条件的F的同分异构体(不含F)共有_________________种;
①能与氯化铁溶液发生显色反应②可以发生水解反应
其中核磁共振氢谱吸收峰最少的同分异构体的结构简 式为___________________________。
式为___________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期末化学试卷(解析版) 题型:选择题
下列有关实验操作的说法正确的是
A.用25mL碱式滴定管量取20.00mL KMnO4溶液
B.用pH试纸测得Ca(ClO)2溶液的pH为10
C.用托盘天平称取20.00 g NaOH固体
D.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则一中高二6月月考化学试卷(解析版) 题型:推断题
A、B、C为原子序数依次增大的同一周期短周期元素,已知A元素的单质既可与盐酸反应,又可与NaOH溶液反应,且均产生氢气;B元素原子次外层电子数比最外层电子数多3,C元素的单质溶于水具有漂白性。
①A元素的元素符号是__________,B的最高价氧化物的化学式为__________;
②B、C两种元素所形成的气态氢化物中最稳定的是__________(用化学式表示);
③写出A、C最高价氧化物对应水化物相互反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则一中高二6月月考化学试卷(解析版) 题型:选择题
按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物。下列反应符合“原子经济”原理的是
A.Cu+2H2SO4(浓)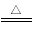 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
C.CH2=CH2+Br2→BrCH2-CH2Br
D.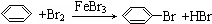
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则一中高二6月月考化学试卷(解析版) 题型:选择题
下列固体投入水中,有气体产生的是
A.Na2O2 B.Na2O C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
某烃的衍生物分子式可写成(CH2)m(CO2)n(H2O)m,当它完全燃烧时,生成的CO2与消耗的O2在同温同压下体积比为1:1,则m、n的比值为
A.1:1 B.2:3 C.1:2 D.2:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下学期期末化学试卷(解析版) 题型:实验题
亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:


查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如右图是所示。
(1)右图中的线2表示的组分为 (填化学式)。
(2)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(3)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。
①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)
③判断Na2SO3产品的等级,并说明理由。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com