
| A. |  | B. |  | C. | 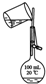 | D. |  |
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2═2H2O△H=-196.6 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-517.6 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ | D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子-分子学说的建立是近代化学发展的里程碑 | |
| B. | 我国科学家于1965年在世界上第一次用化学方法合成了具有生物活性的蛋白质 | |
| C. | 俄国化学家门捷列夫1869年发明了元素周期律 | |
| D. | 中国女药学家屠呦呦发现了青蒿素,显著降低了疟疾患者的死亡率,因此获得2015 年诺贝尔生理医学奖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶解于1L水中 | |
| B. | 将0.25molNaOH溶解于水中配成250ml溶液 | |
| C. | 将1L 10mol/L 的浓盐酸与9L水混合 | |
| D. | 将22.4L氯化氢气体溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.
在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g乙烷含有的共价键数目为8NA | |
| B. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| C. | 1mol甲基含10 NA个电子 | |
| D. | 标况下,22.4L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com