
【题目】向1 L水中通入560 L NH3 (已折算为标准状况的体积),从而形成密度为 0.858g·cm-3的氨水(溶质为NH3),求:
(1)560 L氨气的物质的最为________mol。
(2)氨水的质量分数为_____(保留三位有效数字)。
(3)氨水的物质的量浓度_______。(列出计算过程)
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )
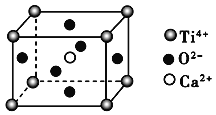
(CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数10亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:

用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59 ℃,沸点为 11 ℃,浓度过高时易发生分解,甚至爆炸。二氧化氯具有强刺激性和腐蚀性。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如图所示:
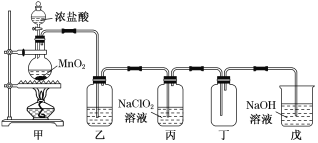
(1)甲装置中圆底烧瓶内发生反应的化学方程式是______________________________________。
(2)Cl-存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。实验过程中常需通入适量的 N2稀释 ClO2,其目的是_____________________________________________。
(3)丙装置中发生的反应为:Cl2+2NaClO2===2ClO2↑+2NaCl 。
下列有关该实验的说法正确的是________________
A. 可用微热法检查实验装置的气密性
B. 如果乙装置是盛有浓硫酸,更有利于实验安全
C. 若甲中足量MnO2与含0.4 molHCl的浓盐酸反应,则丙中可制得0.2molClO2
D. 实验过程甲装置要缓缓加热,不宜强热
(4)戊装置烧杯中NaOH 溶液,其作用是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.
(1)A的结构简式为___________; A中的碳原子是否都处于同一平面?____(填“是”或“不是”);
(2) 在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体.

反应②的化学方程式为__________________________;E2的结构简式是___________________;④、⑥的反应类型依次是________________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )

A. 该反应的ΔH=+91 kJ·mol-1
B. 加入催化剂,该反应的ΔH变小
C. 反应物的总能量小于生成物的总能量
D. 如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
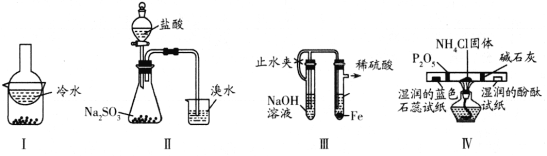
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1) 除去KNO3中混有的SO42-应选择的除杂试剂为__________;
(2) 向沸腾的蒸馏水中滴加饱和FeCl3溶液可制取Fe(OH)3胶体,用化学方程式表示该方法的原理:_______;
(3) 在水溶液中,KHSO4的电离方程式为:______________________________;
(4) 盐酸与氢氧化钠溶液反应的离子方程式为:__________________________;
(5) CO2与足量澄清石灰水反应的离子方程式:__________________________;
(6) 硫酸铜溶液与氢氧化钡溶液反应的离子方程式为:____________________ ;
(7)小苏打常作为食品制作过程中的膨松剂,其溶液与稀HNO3反应的离子方程式为:___;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com